
基因与细胞治疗中质粒的大规模纯化生产工艺剖析
质粒广泛存在于生物界,是细菌、酵母菌和放线菌等生物中染色体以外的遗传物质,具有自主复制能力,并表达所携带的遗传信息。
细菌质粒是闭合环状的双链超螺旋DNA分子,是目前基因治疗领域及疫苗制备中最重要的工具之一,主要有三种应用形式:1)直接体内注射,如DNA疫苗和裸质粒基因载体;2)在体外转染改造靶细胞,如T细胞,然后回输体内;3)在体外多质粒共转染细胞,生产病毒载体,如腺相关病毒(AAV)和慢病毒(LV),继而用于体内或体外基因治疗。
无论裸质粒还是包装病毒载体,最终都是将质粒所携带的目的基因导入靶细胞并表达,进而达到治疗或预防疾病的目的。高质量、高纯度的超螺旋DNA质粒是确保裸质粒、AAV、LV等基因载体安全性和有效性的前提条件。传统商业化的质粒抽提试剂盒难以满足大规模制备基因载体的需求,主要是因为:1)产量低,至多能提供数毫克级的质粒;2)产品质量不稳定,纯度、杂质残留无法达到药用级别标准;3)含有动物源性的RNase,不符合新药申报法规要求。

和元生物自2017年开始研发质粒大肠杆菌高密度发酵工艺和大规模纯化工艺。目前已建立完善的平台化工艺、质量控制和质量保证体系,单次纯化可提供几十毫克至几克质粒,完全满足制备基因载体的大规模生产需求。
本文将着重介绍和元生物GMP平台基于层析的某质粒纯化工艺经典案例。
收集菌体有两种方式:1)离心;2)中空纤维切向流过滤。离心操作在工业生产过程中难以放大;而中空纤维有开放式的通道,能够处理高固含量(大肠杆菌发酵液)、高粘度(菌体裂解液)和剪切力敏感型样品(质粒),并且具有良好的线性放大能力。在这一步推荐使用750kD或0.1-0.2um的1 mm内径的中空纤维进行菌体的收集和清洗。
菌体裂解方法有很多,常用的是碱裂解,由Birnboim和Doly最早提出(Birnboim HC, Doly J. Nucleic Acids Res 1979;7(6):1513–23.)。在碱性条件下,大肠杆菌的蛋白质、RNA、宿主DNA和质粒释放至溶液中并变性。加入中和液后,大量变性的蛋白质和宿主DNA被沉淀,而质粒由于分子量较小,很容易复性并保留在溶液中。
当溶液I、II和III相继加完后,裂解液体积会变得非常大,在层析纯化前进行浓缩和洗滤,不仅可以大大减小样品体积,还可以有效去除RNA、色素和部分宿主蛋白、宿主DNA等杂质,减少层析阶段的负荷。对于质粒的超滤浓缩,一般按照如下表格标准进行NWMC的选择,中空纤维的低剪切力特点可以有效保护质粒的超螺旋构象。此外,平板膜包也可以用于本步超滤浓缩,但是根据不同质粒的大小,MWCO的选择可能与中空纤维的略有差异。

经过超滤浓缩后,样品中主要杂质有RNA残留、开环DNA和内毒素。针对这三种杂质,通过以下三步层析一一去除。
凝胶过滤层析的目的是去除大量RNA残留。高浓度硫酸铵(≥1.5 M硫酸铵)的平衡液使RNA和质粒的空间大小的差异性达到了最大,质粒通过层析柱的外水体积首先流出。组群分离(Group separation)模式使其上样体积达到了0.3CV。本步层析以后,质粒已经达到了很高的纯度,琼脂糖凝胶电泳几乎看不到RNA杂带,见如下电泳图所示。
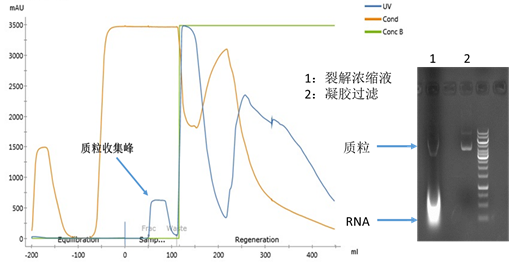
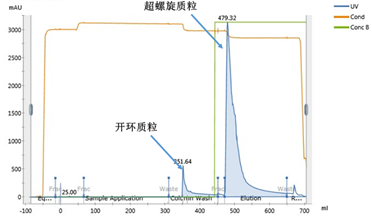
亲和层析的主要目的是去除开环质粒。凝胶过滤得到的质粒被置换到高浓度硫酸铵的缓冲液,可以直接上样至亲和层析柱,在此条件下,开环和超螺旋质粒均与填料结合;上样结束后,首先用2.0 M硫酸铵的缓冲液冲洗开环质粒;然后用含1.7 M硫酸铵和0.3 M氯化钠的缓冲液将超螺旋质粒洗脱,实现开环质粒与超螺旋质粒的分离。
经过前两步层析,质粒的纯度和均一性(超螺旋比例)达到了新高度,最后一步层析重点是去除内毒素。来源于大肠杆菌,内毒素始终是质粒的一个重要风险杂质。市面上无内毒质粒抽提试剂盒,其内毒素能达到的标准也只有<100 EU/mg质粒。
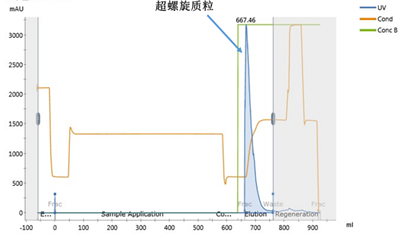
同裂解液的超滤浓缩一样,使用中空纤维或平板膜包,将质粒浓缩换液至制剂缓冲液中,用于转染细胞的质粒一般换液至Buffer TE中。
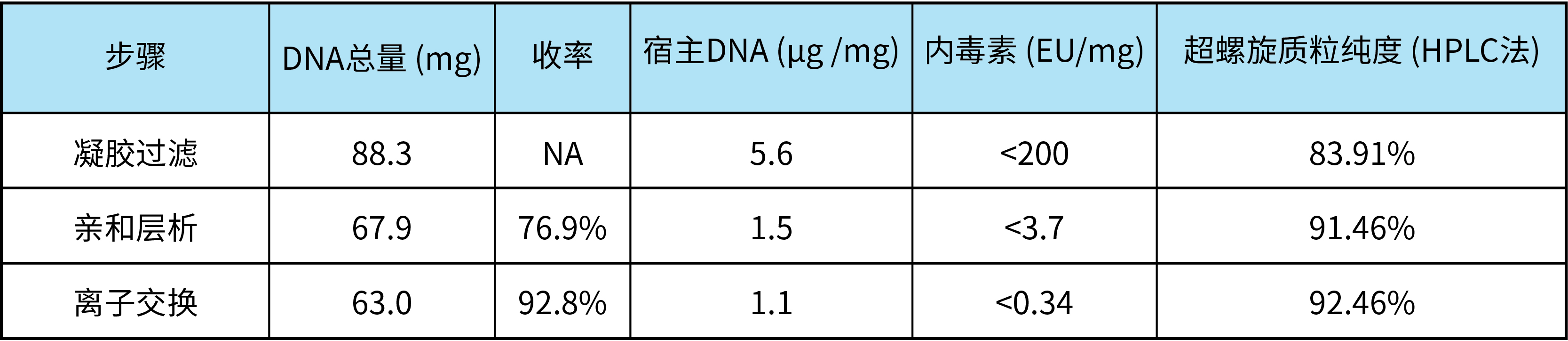
对该质粒三步层析中间样品进行检测,结果如下表所示。可见,经过三步层析后,超螺旋质粒纯度大于90%,内毒素和宿主DNA残留分别小于10 EU/mg和2 μg/mg。
以上为和元生物GMP平台成立以来,基于层析的某质粒纯化工艺案例分享。质粒的高质量和高纯度是确保后续裸质粒或病毒载体安全性和有效性的前提,是工业化生产步骤重要环节之一。
目前,和元生物GMP平台已与多家基因和细胞治疗药物企业开展合作,拥有上百批次质粒和病毒生产经验。已开发和生产出多种符合中美新药申报标准的临床级病毒载体,如rAAV2/2、rAAV2/5、rAAV2/8、rAAV2/9、溶瘤腺病毒、痘苗病毒、水疱性口炎病毒、单纯疱疹病毒、慢病毒和多种裸质粒等。完善的技术平台和质量管理体系,最大程度确保产品的稳定高质量生产,为客户提供高品质产品及服务。
和元生物基因和细胞治疗载体CDMO平台可提供从非注册临床研究用质粒和病毒生产、基因治疗新药临床申报整体方案到基因治疗临床样品及商业化GMP生产的整体服务,服务产品包括基因和细胞治疗用质粒、腺相关病毒、慢病毒、腺病毒、多种溶瘤病毒以及基因疫苗等新型基因载体。
基于近4500m2的基因载体研发生产综合平台、近7000m2的基因载体GMP生产平台,以及2020年启动建设的近8万平米和元智造精准医疗产业基地,和元将持续专注于基因治疗CDMO服务,助力基因治疗造福人类。


扫一扫,反馈当前页面
和元生物