
【Nat Commun.】华师大叶海峰团队创新研究:非侵入性远红外光诱导的Split-Cre系统调控基因重组
2020年7月,华东师范大学生命学院叶海峰研究员团队在杂志《Nature Communications》上发表了题为“A non-invasive far-red light-induced split-Cre recombinase system for controllable genome engineering in mice”(原文链接:https://pubmed.ncbi.nlm.nih.gov/32709899/)研究成果。该研究构建了一种基于远红外光诱导的裂解Cre-loxP体系,实现了利用远红外光对体内基因进行调控的目的。
由于Cre-loxP重组体系能够有效克服其他类型重组技术的非特异性或重组效率低等缺点,近年已逐渐在功能基因研究领域占据主导地位。Cre-loxP技术和化学诱导结合,可以实现基因重组的时间特异性,然而,化学诱导的Cre-loxP具有细胞毒性、泄漏、脱靶等劣势,例如心血管研究中常用的tamoxifen诱导的Cre-loxP体系,tamoxifen可能会产生心功能障碍等症状[1],影响研究结果。与化学诱导体系相比较,光遗传学避免部分了化学诱导体系的劣势。但是,UV诱导的Cre-loxP体系[2]仍具有细胞毒性;蓝光诱导的CRY2-Cre体系[3],因其穿透组织能力较差、重组效率低等问题,所以在体内研究应用的过程中仍具有局限性。远红外光和近红外辐射能够有效的渗透到组织和器官中[4]。
叶海峰研究员团队基于split-Cre重组系统和远红外光(FRL)可诱导光遗传系统建立了远红外光诱导的split Cre-loxP体系(FISC,far-red light-induced split Cre-loxP system)。在该体系中,Cre酶被分为两个片段,N端Cre融合到一个Coh2结构,融合表达CreN-Coh2蛋白;C端Cre融合到一个DocS结构,融合表达DocS-CreC蛋白;在FRL光照条件下, Coh2和DocS在强亲和力的作用下结合,从而Cre酶也被重新组合[5]。该体系,具有本底渗透低,无明显细胞毒性,重组效率高,时间可控性等特点。实现了条件性非侵入的基因调控目的,为生物研究和治疗提供了一种有效的工具。
基于对Cre酶的结构分析,将Cre酶CreN59/CreC60分离,构建FISC系统(图1a)。在FRL光照条件下,DocS-CreC60融合表达与Coh2-CreN59结合,Cre酶2个片段重新组合,可以切除2个loxP位点间的DNA序列(图1b)。为了降低背景的影响,提高DNA重组效率构建了3个FRL应答的启动子PFRLx(图1c),并对不同启动子的启动效果进行比较,结果发现在TATA启动子的控制条件下,DocS-CreC60的光诱导重组效率更好(图1d);4个质粒比列为10:1:1:20时共转染HEK293细胞时,FRL诱导的DNA重组效率最高(图1e);L9/L9链接方式在FRL诱导时DNA重组效率最高(图1f)。
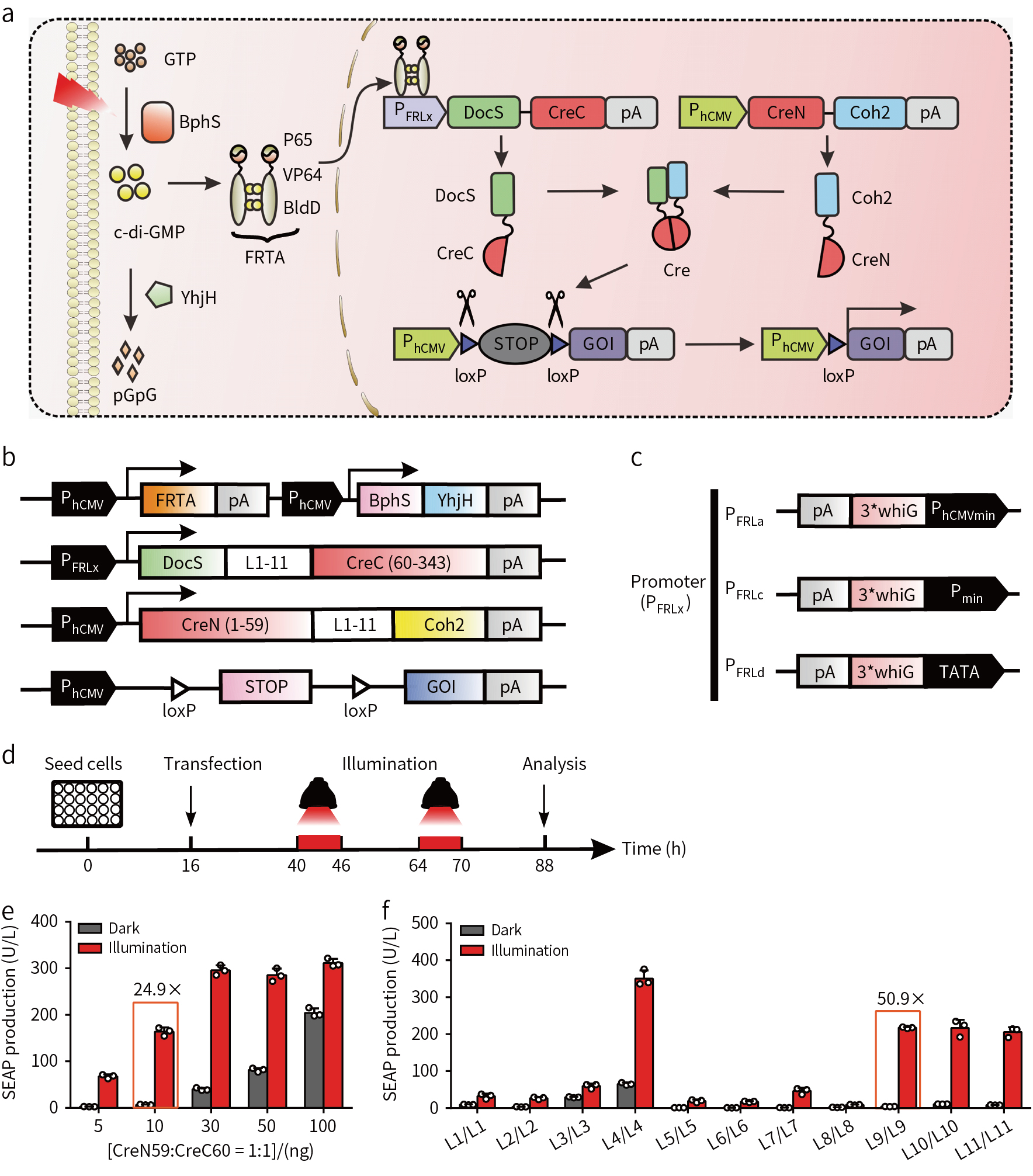
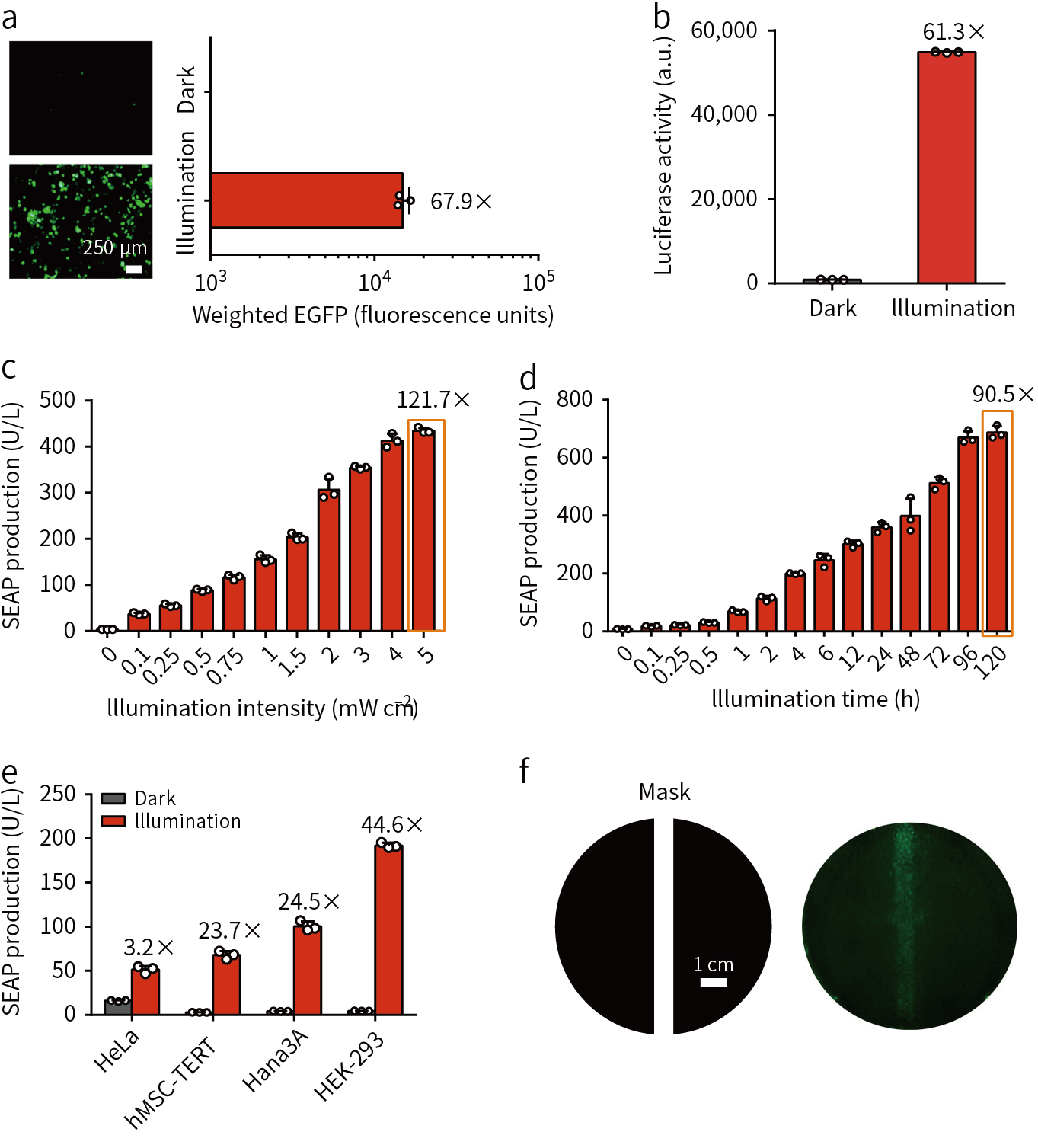
为了证明在哺乳动物细胞中对Cre酶活性的作用,在HEK-293细胞转染FISC质粒和带有loxP位点的绿色荧光蛋白(EGFP)或荧光素报告酶(Luciferase reporter)基因,结果表明,具有FISC的细胞在FRL作用下发生重组,无FRL时基因重组水平极低(图2a, b),且DNA重组的效率与FRL光照强度和光照时间呈现正相关关系(图2c, d)。除了HEK-293细胞外,FISC也可以激活其他细胞的基因重组(图2e),利用光掩膜控制FRL照射的空间区域(图2f),证明了该系统的高空间分辨性。FISC系统中,FRL没有明显的细胞毒性且具有更高效的DNA重组。
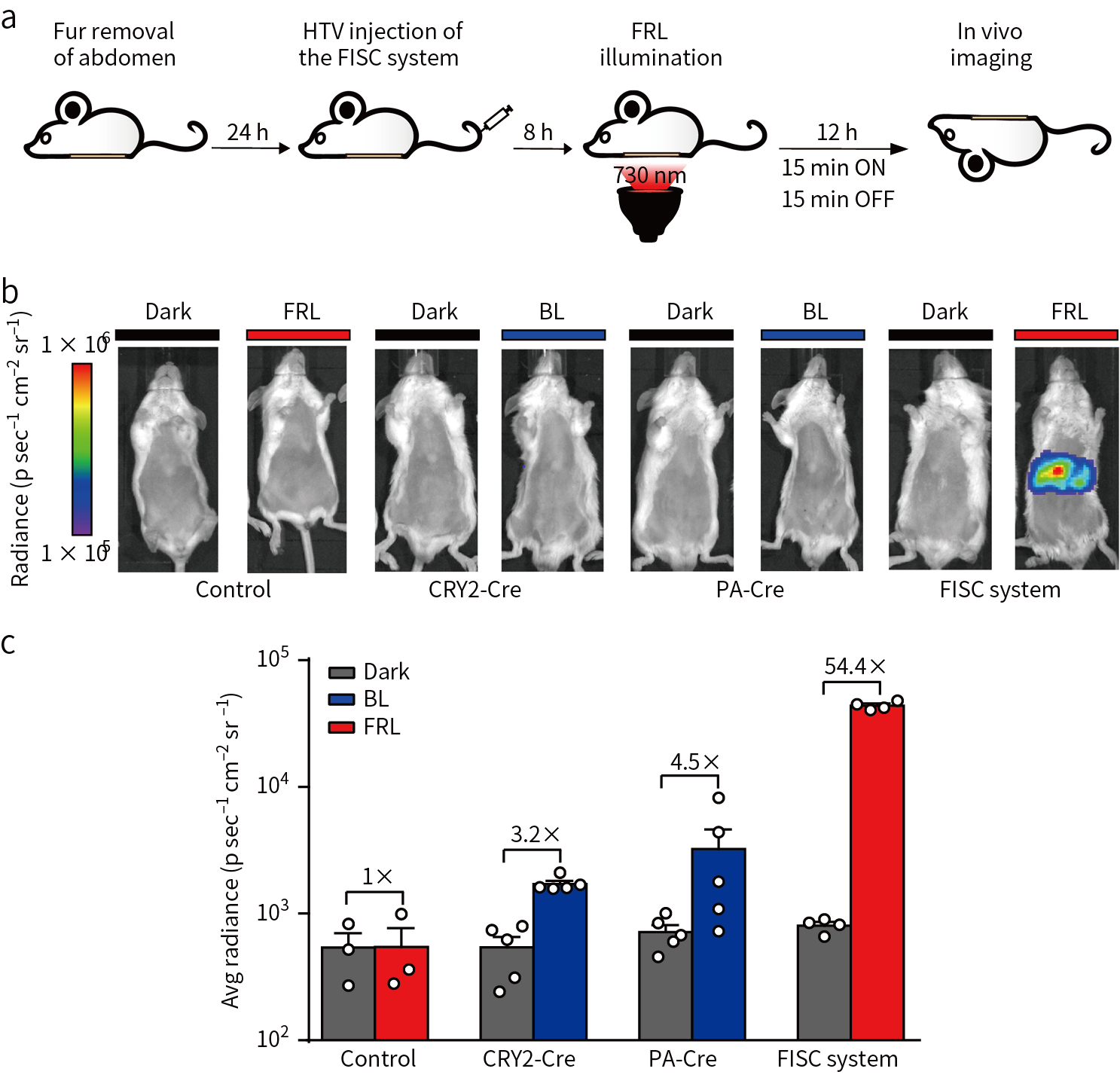
接下来对FISC系统能否在动物体内发挥作用进行探究。小鼠尾静脉高压注射3个质粒的FISC系统,8h后FRL照射小鼠腹腔,结果显示,FRL照射12h表现出高荧光素酶活性(图3a, b)。同时对不同的光诱导系统进行比较发现,携带FISC系统的小鼠,光照后荧光素酶活性明显高于其他系统图(图3b, c)。
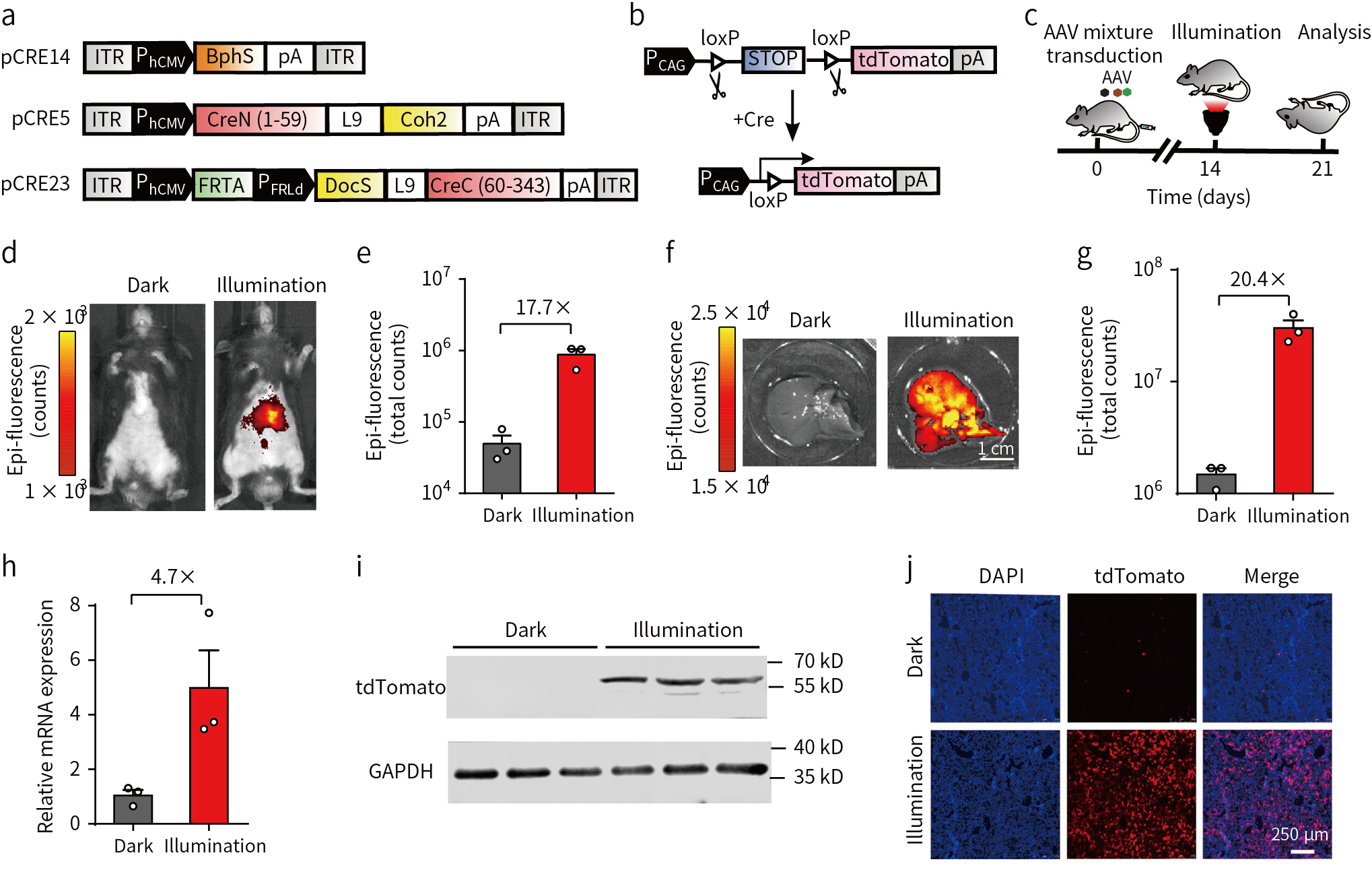
AAV载体作为生物研究和临床治疗的首选病毒载体,具有较低的免疫原性和致癌风险。为了使该系统在未来的疾病治疗中具有更为广阔的应用前景,因此研究人员通过AAV载体将FISC系统导入tdTomato小鼠。由于AAV载体的容量限制,所以将FISC系统重新设计3个AAV病毒载体(图4a)。将3个病毒载体混合通过尾静脉注射到小鼠体内(图4b, c),3周后荧光成像显示暴露于FRL下的小鼠比未暴露于FRL下的小鼠基因转导效率增加17.7倍(图4d, e),并且检测发现肝脏中信号最强(图4f, g),对肝脏组织进行qRT-PCR和WB分析(图4h, i),AAV载体介导的FISC系统在FRL照射条件下基因表达水平和蛋白表达水平均显著增高,肝脏组织切片结果也证明了FRL诱导下表达增加(图4j)。以上结果表明,与其他两种给要方式相比,AAV药物治疗FISC系统在体内表现出更高的性能,具有作为一种临床治疗方案潜在发展前景。
FISC系统可通过AAV在动物体内实现高效的基因重组,能够进行条件性的基因操作,并且具有良好的时间可控性、高渗透性、低毒性和低侵袭性的特点。因此,FISC系统可用于多领域的基因编辑工作。

和元生物为代谢相关研究提供整体研究方案,从动物造模、基因筛选、基因操作、病毒包装、生理病理检测、机制探究、到观察验证等一站式服务。用专业、认真、严谨的科学态度为代谢研究助力。

扫一扫,反馈当前页面
和元生物