
【Nature】精准医疗时代已来临,首个个体化癌症疫苗临床效果显著
随着人类基因技术的进步与大数据时代的到来,从科研领域的全基因组测序(WGS)到临床应用的无创产前基因检测,基因的作用和重要性日益凸显。基因研究正在不经意间以其巨大的力量改变着人们的生活,使人类对自身的认知进入到了一个新的层面。

自2015年1月20日,美国总统奥巴马在国情咨文中提出“精准医学计划”后,个体化医疗概念逐渐兴起,这不仅激发了人们对基因测序的需求,也使得基因测序商业化、大众化的意愿成为了科研界和临床应用界的共识。
肿瘤细胞的特点是持续的快速生长和增殖,因此肿瘤细胞往往会伴随大量基因的新发突变,使其出现许多新的突变蛋白,科学家称之为肿瘤新抗原。此外,即使同种癌症患者身上的突变都不尽相同,导致肿瘤新抗原也有所差别。因此,应用全外显子测序筛选出不同患者的特异性肿瘤新抗原,并制备特异的肿瘤疫苗,成为个体化精准治疗的有效策略[1]。

基于全外显子测序筛选肿瘤疫苗的基本策略
黑色素瘤一般指恶性黑色素瘤(malignant melanoma,MM)。它是皮肤恶性黑色素瘤的一种,与皮肤鳞状细胞癌及皮肤基底细胞癌共同组成最常见的皮肤三大恶性肿瘤。黑色素瘤多由黑色素细胞所形成的痣或黑色素斑发生恶变而来。黑色素瘤已成为近年来所有恶性肿瘤中发病率增长最快的恶性肿瘤,年增长率3%-5%。并且,恶性黑色素瘤一旦进入快速生长期,则患者预后极差、病死率较高。黑色素瘤基因组的突变频率在肿瘤中是最高的,肿瘤新抗原为点多,容易被筛选到适宜的被免疫T细胞识别位点,因此是研究个体化肿瘤疫苗的首选模型[1]。目前,黑色素瘤个体化肿瘤疫苗在体外和小鼠体内已取得显著的治疗效果[2,3]。
那么人体黑色素瘤个体化肿瘤疫苗是否也会有显著的治疗效果呢?2017年7月5日Nature杂志同期发表了两篇关于黑色素瘤“个性化疫苗”在临床上取得的重大突破的文章 :“Personalized RNA mutanome vaccines mobilize poly-specific therapeutic immunity against cancer”和“An immunogenic personal neoantigen vaccine for patients with melanoma”。

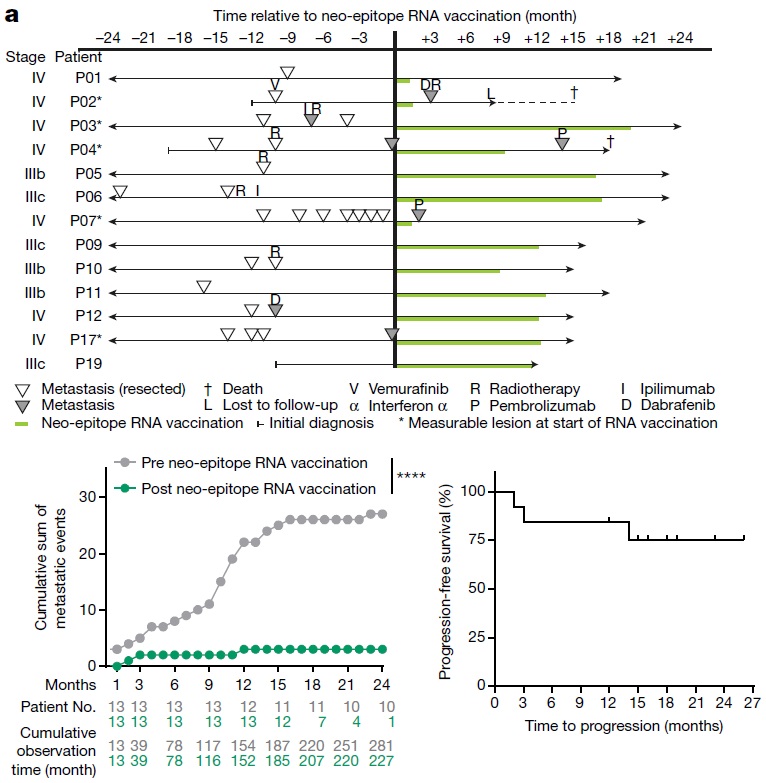
来自德国Cluster for Individualized Immunointervention的团队,对黑色素肿瘤病人肿瘤组织进行全外显子和RNA测序。筛选携带非同意突变、表达水平高并且和HLA有很高亲和性的基因,然后5个突变位点(肿瘤新抗原)串联在一起制备成个性化RNA疫苗。他们为每位患者制造了2组RNA疫苗(P09病人为1组)[4]。

筛选制备个体化RNA黑色素瘤疫苗的策略
作者在13位黑色素瘤患者身上展开了试验。结果显示,RNA疫苗60%在患者体内引起了T细胞免疫反应,其中8位患者在接受疫苗后一年内没有出现复发迹象,其他已经出现肿瘤转移的5名患者在接受疫苗后,2名患者肿瘤缩小,另外1名患者在接受PD-1抗体药物后得到完全缓解[4]。

RNA疫苗引起T细胞免疫反应
RNA肿瘤疫苗治疗效果
另外,来自美国波士顿Dana-Farber癌症中心的Catherine J. Wu教授,对黑色素肿瘤病人肿瘤组织进行全外显子和RNA测序。筛选携带非同意突变并且和HLA有很高亲和性的基因,制备包括13-20种不同的含有新肿瘤抗原的多肽疫苗。

Catherine J. Wu教授
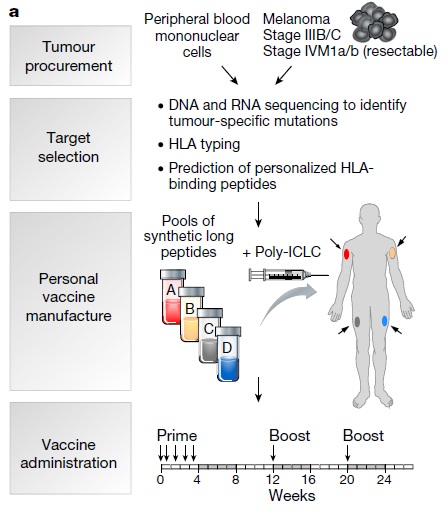
筛选制备个体化多肽黑色素瘤疫苗的策略
结果显示,多肽疫苗60%在患者体内引起了T细胞免疫反应。在接受疫苗治疗的6位患者中,4位患者在25个月内没有出现复发迹象。另外2名患者出现了复发迹象,但是在接受了PD-1抗体药物治疗后获得了完全缓解。
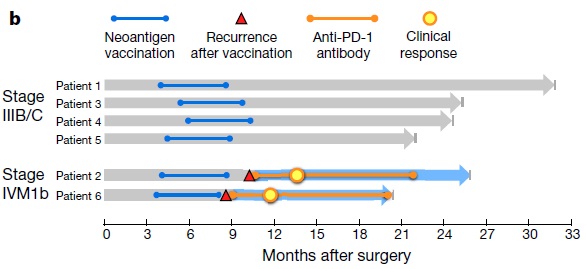
多肽肿瘤疫苗治疗效果
两个研究采用了两种不同的肿瘤新抗原疫苗,并且在小规模的临床试验中均取得了显著的治疗效果,有异曲同工之妙。此外临床治疗结果数据还提示,这类新抗原疫苗与PD-1抗体药物能够产生协同效应,这将会是下一步研究的重点方向。
但是目前这个方法目前还面临着一些挑战。一:如何保证剔除冗余的信息,筛选到有效的肿瘤新抗原靶点,成功激活免疫T细胞。二:怎么保证快速的完成疫苗的制备,文章中提到RNA疫苗的制备检测需要89-160天。对于晚期癌症患者来说,这么长的时间内病情很可能极度恶化甚至死亡。此外,新抗原疫苗在其它肿瘤中能否取得同样的效果还有待试验证实。
肿瘤疫苗和现在最热门的CAR-T在技术原理上有相似之处:首先筛选到肿瘤细胞的特异性抗原,再通过基因工程放大肿瘤特异性抗原信号,从而激活免疫T细胞,产生主动免疫治疗肿瘤。但是肿瘤疫苗比CAR-T的特异性更强,其副作用相对较小,同时肿瘤疫苗技术流程更加简单,因此临床应用前景更好。
参考文献:
[1] Schumacher, T. N. & Schreiber, R. D. Neoantigens in cancer immunotherapy. Science 348, 69-74, doi:10.1126/science.aaa4971 (2015).
[2] Castle, J. C. et al. Exploiting the mutanome for tumor vaccination. Cancer research 72, 1081-1091, doi:10.1158/0008-5472.CAN-11-3722 (2012).
[3] Kreiter, S. et al. Mutant MHC class II epitopes drive therapeutic immune responses to cancer. Nature 520, 692-696, doi:10.1038/nature14426 (2015).
[4] Sahin, U. et al. Personalized RNA mutanome vaccines mobilize poly-specific therapeutic immunity against cancer. Nature, doi:10.1038/nature23003 (2017).

扫一扫,反馈当前页面
和元生物