
【Cell Metabolism】梦想成为“吃不胖的瘦子”,家中常备肌酸
我们周围总会存在一种人,那就是怎么都吃不胖的瘦子。我们吃饭的时候他在吃,我们不吃的时候他还在吃,可是人家就是吃不胖。而我们,喝个凉水都怕胖!!!

那么为什么个体会有这么大差异呢?根本上讲体重是由能量的摄入和消耗平衡决定的,如果摄入增加或者消耗降低就会导致肥胖。
机体中能量平衡是由中枢-外周组成的环路调控的。我们进食后,会导致胰岛素的分泌增加,促进脂肪细胞脂滴中甘油三酯的增加,从而导致脂肪细胞的肥大;当胃排空之后,肠的胃饥饿素(ghrelin)分泌增加,作用于丘脑刺激进食、抑制脂肪的分解[1]。
而脂肪细胞中脂肪过度积累后会分泌瘦素(leptin),瘦素作用于丘脑激活POMC神经元、抑制AgRP神经元,从而抑制进食。同时丘脑可以分泌儿茶酚胺促进脂肪细胞中甘油三酯的分解[1-3]。
所以,进化中形成的“幸存机制”作用下,我们的机体可以存储能量。
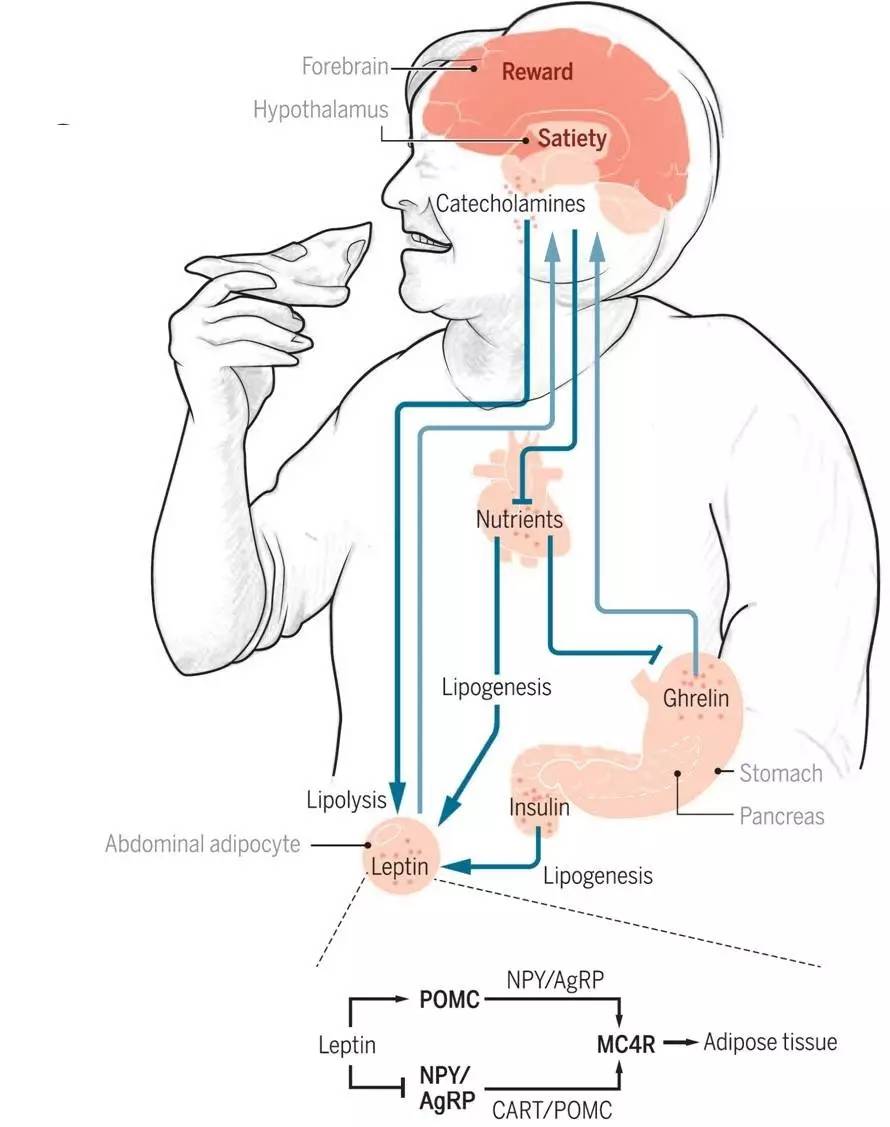
Saltiel AR. et al., Science translational medicine 2016
之前研究发现如果人为打破上述能量平衡,比如控制饮食,机体会下调基础代谢率,使能量消耗降低,以抵抗体重的降低[4];而增加饮食,机体会增加能量的消耗以抵抗体重的增加[4],机体的这一生热作用被称为“饮食诱导的生热作用”或者“进食热效应”,那么“进食热效应”是由什么介导的呢?
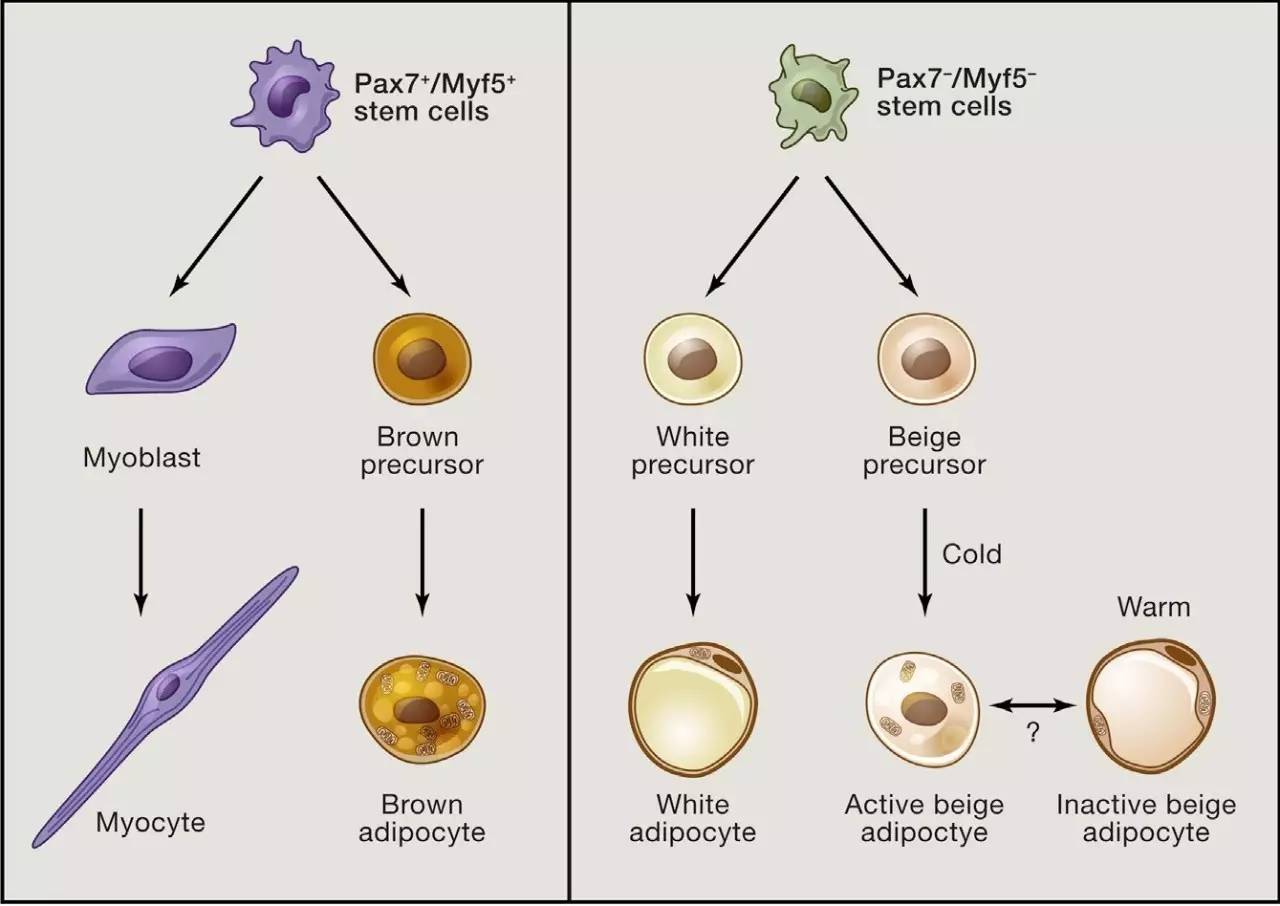
在机体中脂肪组织分为白色脂肪、米色脂肪和棕色脂肪,白色脂肪组织是存储脂肪的主要器官,而棕色脂肪、米色脂肪含有大量的线粒体,高表达UCP1,可以燃烧脂肪[5]。机体的非震颤产热主要是由米色脂肪和棕色脂肪中的UCP1介导的[5]。那么UCP1是否参与了“进食热效应”呢?
之前的研究发现Ucp1敲除小鼠在给予高脂饮食之后,和野生型小鼠的产热相比并没有变化[6],提示在“进食热效应”还有其它因素的参与。
2015年哈佛医学院的Spiegelman教授在Cell上发表文章,发现肌酸(Creatine)可以促进米色脂肪组织的产热,并且是不依赖于UCP1的新产热途径[7]。那么新发现的肌酸促进产热途径,是否是“进食热效应”的通路呢?
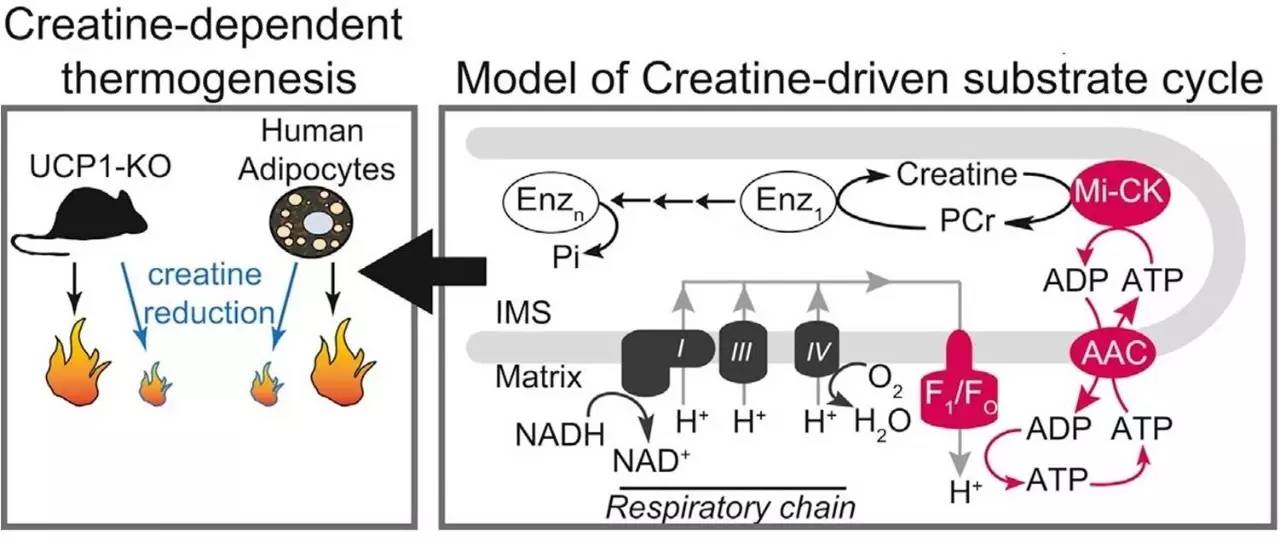
为了进一步研究肌酸产热在“进食热效应”的作用,Spiegelman教授将肌酸合成的限速酶—GATM在脂肪组织特异性敲除。这项工作于8月24日发表在Cell Metabolism上[8]。
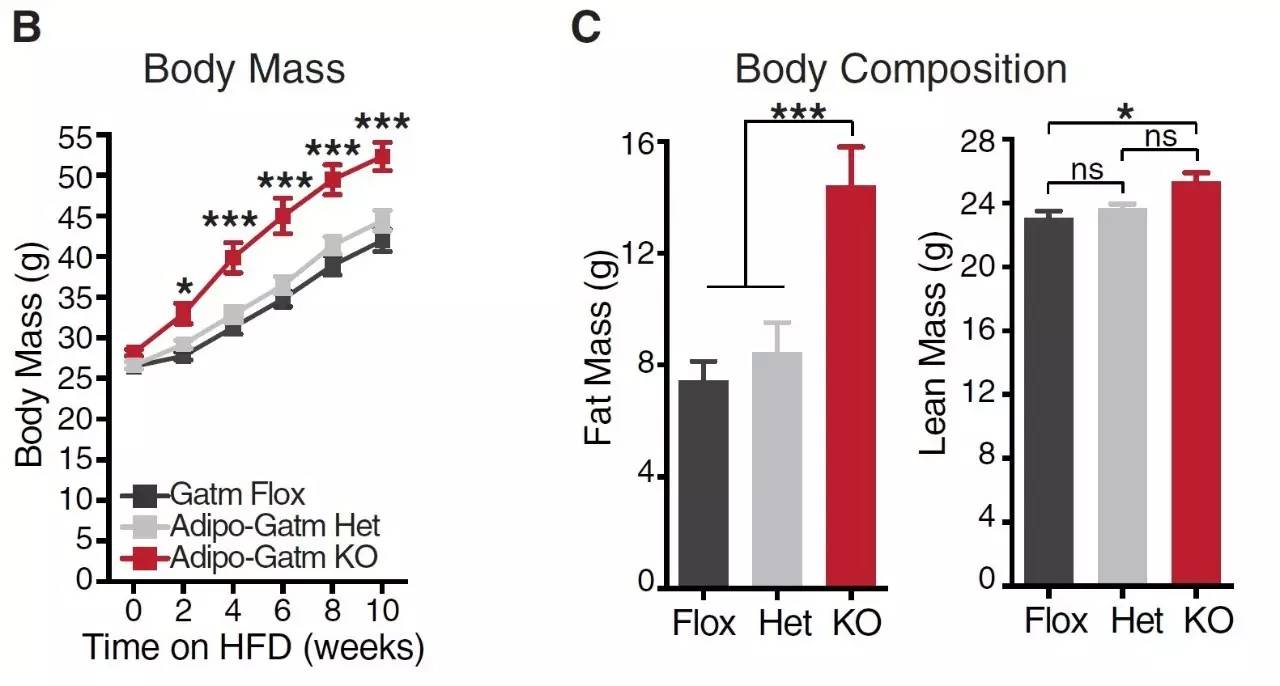
该项研究中,和预期相符Gatm敲除小鼠在高脂喂养后体重增加相比野生型和杂合小鼠更加明显(下图左红线),同时体脂含量更高(下图右红色柱子)。
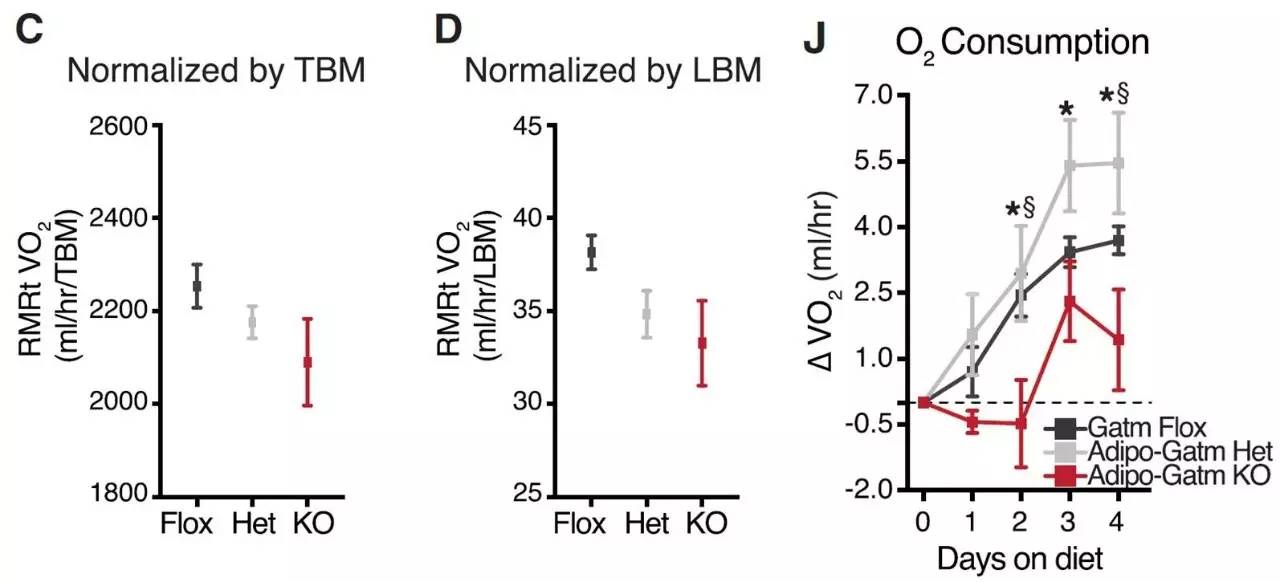
非常有意思的是,作者发现Gatm敲除小鼠的基础代谢率,在矫正体重和肌肉含量后明显降低(下图C、D)。作者进一步观察长效高脂饮食发现,和人的研究结果一致,高脂饮食后野生型小鼠的代谢率会上升(下图J灰线),也就是前文介绍的“进食热效应”,而Gatm敲除后“进食热效应”会明显的被抑制(下图J红线)。这提示肌酸可能参与了“进食热效应”。
那么给予Gatm敲除小鼠肌酸是否可以重新出现“进食热效应”呢(下图左蓝色)?作者发现当喂食Gatm敲除小鼠肌酸后其代谢率明显升高,即重新获得了“进食热效应”(下图右蓝色)。
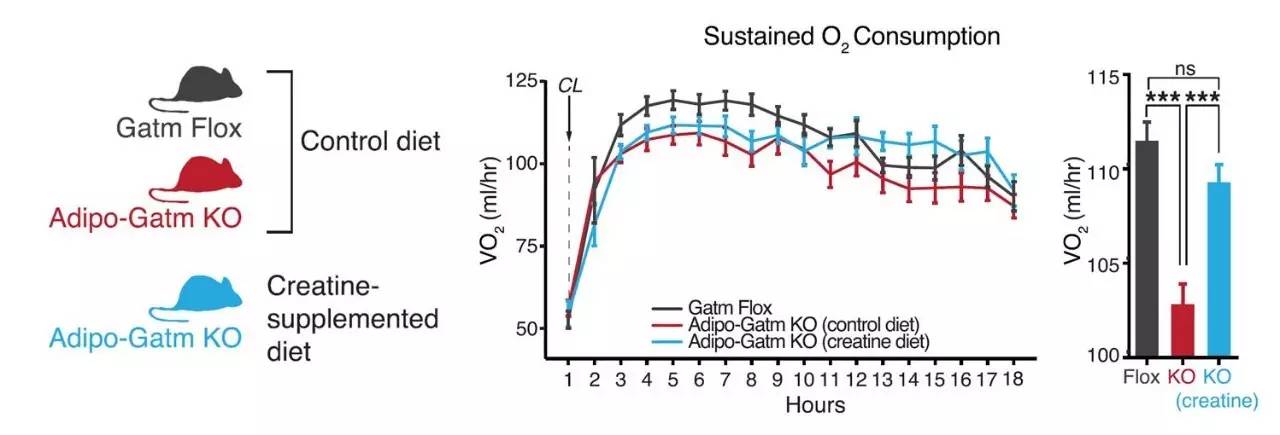
因此综合以上结果提示肌酸参与了机体的“进食热效应”,当机体能量摄入过多时,肌酸会促进机体提高代谢率抵抗肥胖的发生。
我们每个人机体中的肌酸代谢水平是不同的,有的人肌酸水平高,那么当其吃的东西过多、营养过剩时,其机体的基础代谢率会明显上调,能量消耗增加,从而导致其怎么吃都不会变胖。
或许不久的将来,吃货再也不用控制自己的嘴了,只要没事多来点肌酸。

扫一扫,反馈当前页面
和元生物