
【Nature Neuroscience】重大突破:“出恭”是怎么控制的?
活人能被尿憋死?

没错,研究发现,排尿困难并非小事,它发生在男女老少各种人群身上,每年困扰着数以百万计的患者。排尿(Urination)是一个相当复杂的生理动作,它是动物从膀胱将尿自尿道排出体外的过程,其目的是清除代谢废物,维持机体的体液平衡。健康人类的排尿过程可以自主控制,而一些神经受损者不能控制排尿。这种运动需要有良好的膀胱肌肉收缩、通畅的尿道以及神经系统协调,调节排尿的大脑中枢包括脑桥排尿中枢(PMC)、导水管周围灰质和大脑皮层。这其中任何一个环节病变都可能造成膀胱的排尿动作受到影响,导致排尿功能障碍,更甚者会诱发心血管疾病危及生命。
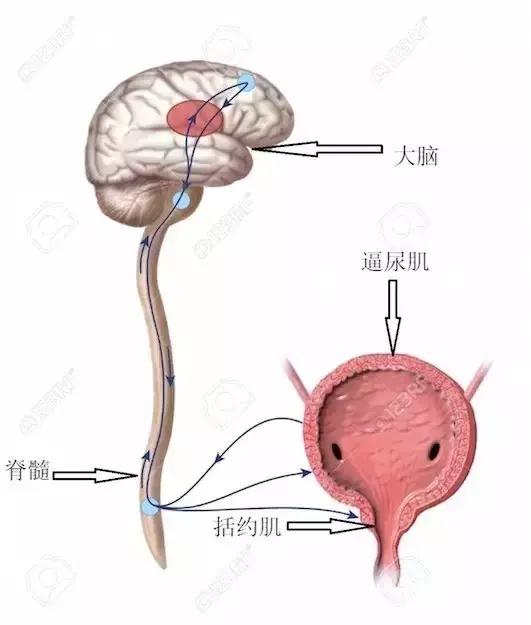
过去的研究已经在脑皮层(如PMC)中发现与排尿有关的神经元,但这些研究并未对自发性排尿控制的神经环路机制做明确的阐述。
2018年10月25日,《Nature Neuroscience》杂志在线刊登了第三军医大学姚基伟博士等人的重磅工作,该课题由第三军医大学鄢俊安课题组、谌小维课题组与中国科学院上海生命科学研究院许晓鸿课题组合作完成[1]。
他们利用病毒示踪、光遗传学、化学遗传、在体光纤记录等技术,首先确定了初级运动皮层的一小簇第5层(L5)神经元的活动与排尿行为密切相关,并进一步确定这群神经元通过投射PMC触发排尿行为。本篇文章首次解读了L5皮层神经元投射到PMC诱发排尿动作的神经回路机制,不仅极大提高了人们对该领域的认知,也为治疗排尿功能障碍相关疾病提供了新的思路。
实验结果
1.M1区L5神经元的活动与排尿密切相关
利用伪狂犬病毒的逆向示踪,作者首先标记了成年雄性小鼠膀胱壁与初级运动皮层和初级感觉皮层的逆向跨突触的联系(图1),且这些投射多位于皮层M1和S1区的第五层(图1b-f)。
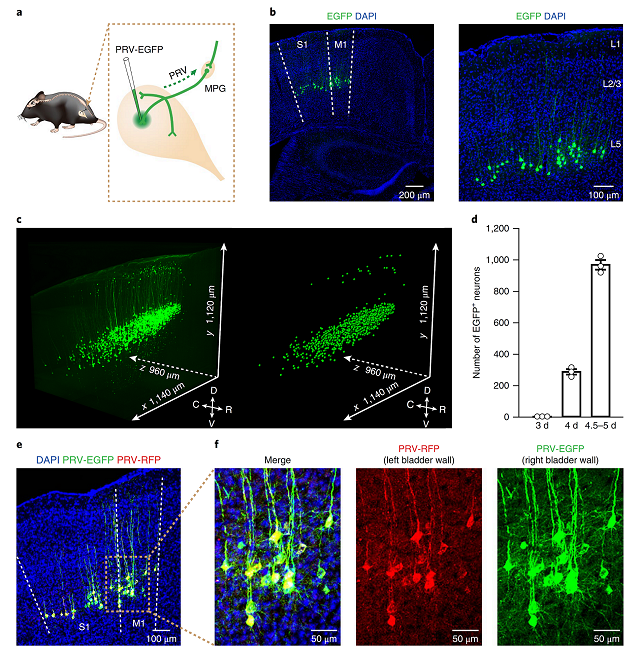
图1 L5皮层锥体神经元标记
借助基于光纤记录的钙成像技术和AAV病毒载体,作者记录标记上述L5皮层神经元是否参与了排尿行为(图2a-b),结果发现Ca2 瞬时变化在尿液释放开始前立刻被捕捉到(图2c-d),在所有的记录中,约94%的排尿与M1区Ca2 瞬时变化有关(图2e-f)。进一步,作者发现M1区L5神经元的膀胱压力峰值与Ca2 瞬时变化密切相关(图2h-i),且M1区神经元向膀胱传递的通路活动与排尿正相关(图2j-k)。这些结果提示M1区 L5皮层神经元可能在排尿的起始过程中扮演着重要的角色。
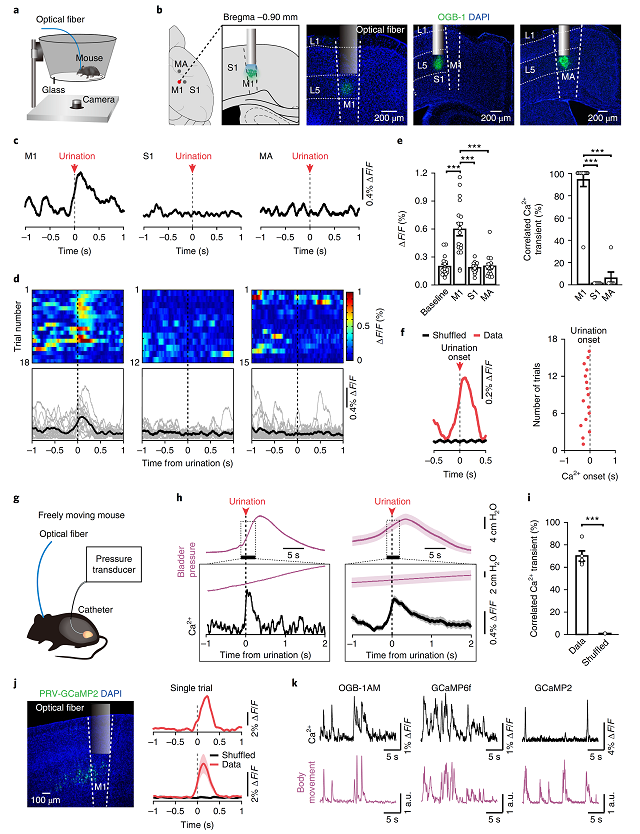
图2 M1区L5神经元的活动与排尿密切相关
2.激活大脑M1区L5皮层兴奋神经元会触发膀胱收缩和排尿
接下来,研究人员双侧注射AAV病毒载体(AAV-CaMKⅡ-ChR2-mCherry)表达光敏感通道,并用光遗传学技术刺激这些神经元,记录麻醉动物膀胱尿道肌肉的电活动(图3a)。发现,蓝光激活表达ChR2的M1区神经元时,膀胱逼尿肌的电活动增强、肌肉收缩(图3c-e),同时膀胱压力值显著增加(图3f),提示了激活大脑M1区L5皮层神经元会引起膀胱收缩,增长收缩时间。
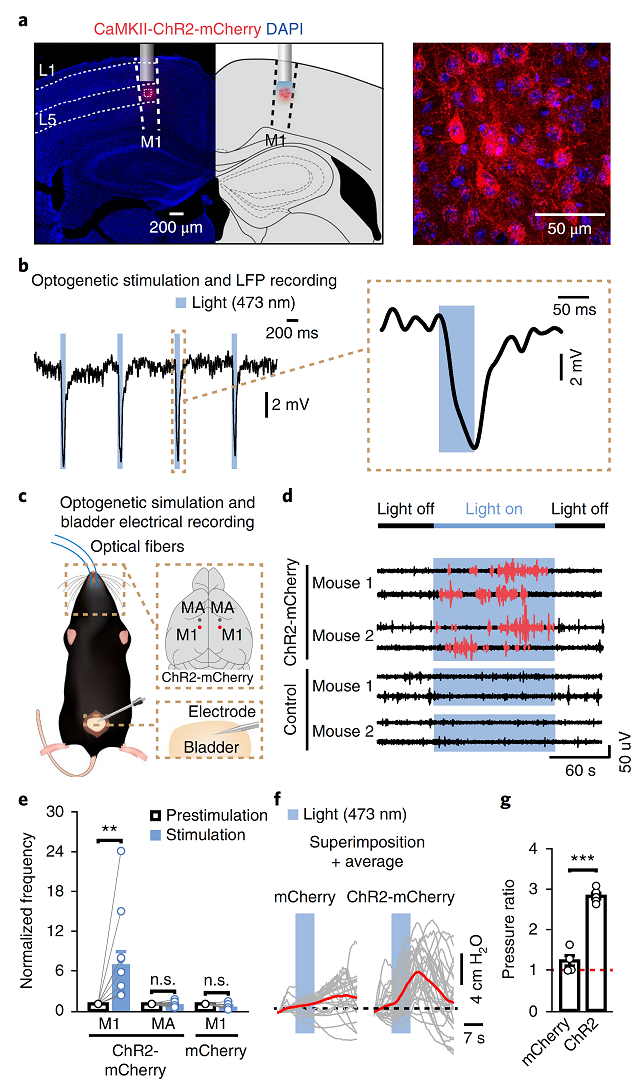
图3 光刺激L5兴奋性神经元导致膀胱收缩
进一步,作者用光遗传学技术(图4a)直接激活M1区L5神经元,发现该操作可以引起自由活动小鼠的排尿行为,且排尿行为发生在光刺激的4min内(图4b-d)。
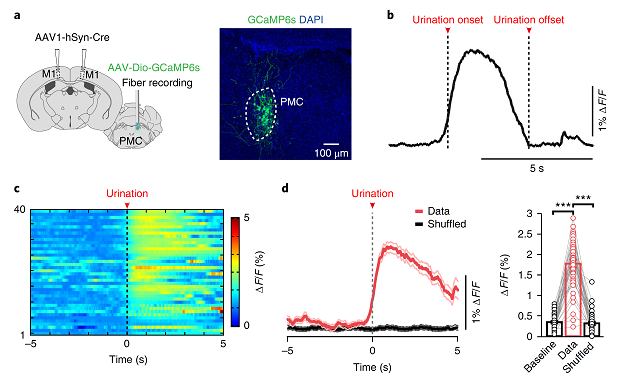
图4 光刺激L5神经元会引发排尿动作
3.大脑M1区L5皮层神经元通过投射到PMC导致排尿
接下来,作者使用基于AAV病毒载体的病毒环路示踪技术,探索M1区L5神经元介导膀胱收缩和排尿行为的神经环路。
通过局部注射AAV-CaMKⅡ-EGFP病毒,作者发现L5神经元其可直接投射到PMC区。随后,研究人员在M1区和PMC分别注射具顺向跨突触能力的AAV病毒--AAV2/1-hSyn-Cre和AAV-DIO-GCaMP6s,发现这群投射到PMC的锥体神经元参与排尿行为(图5a),且实验结果显示Ca2 的瞬时变化开始于排尿前,并持续整个排尿过程(图5b-d)。
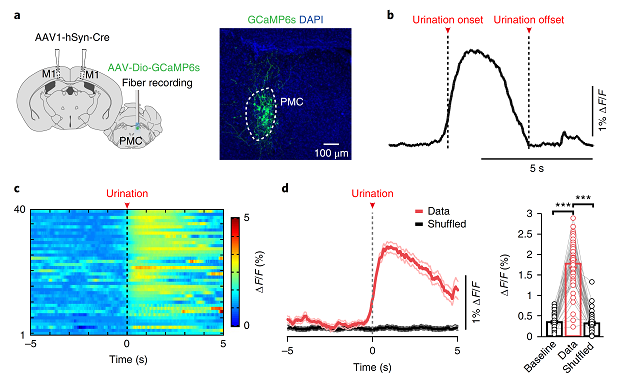
图5 排尿相关Ca2 信号
进一步,研究人员在M1区注射AAV2/1-hSyn-Cre和AAV-DIO-ChR2病毒,同时在PMC注射AAV-DIO-GCaMP6s病毒(图6a),结果发现,用光刺激大脑M1区L5锥体神经元可显著性增加Ca2 浓度(图6b)。研究还发现,PMC神经元活性是L5皮层神经元触发排尿活动(图4)所必需的(图6c-d)。此外,作者利用病毒示踪技术发现对PMC神经元进行光刺激会导致行为自由小鼠的排尿动作(图6e-g)。
综上,这些病毒示踪的结果提示了这些大脑M1区L5锥体神经元通过激活PMC导致排尿行为(图6h)。
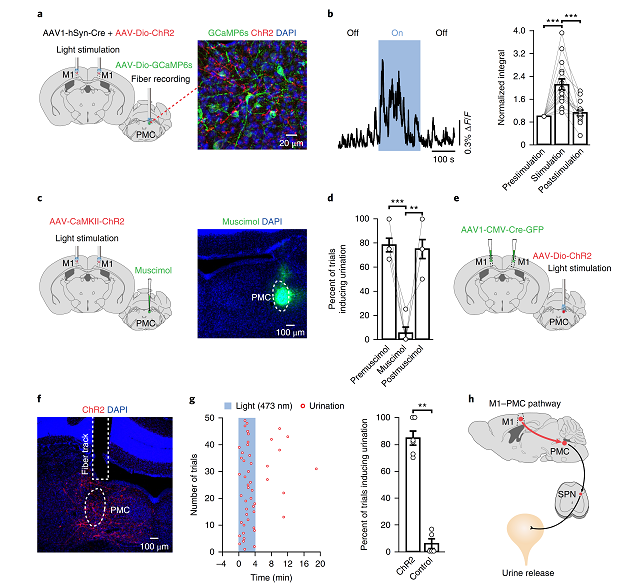
图6 大脑M1区神经元通过激活PMC控制排尿行为
4.大脑M1区L5皮层锥体神经元是正常排尿行为所必需的
最后,作者利用化学遗传技术(基于AAV-CaMKⅡ-hM4Di-mCherry),使用CNO抑制M1区L5皮层神经元(图7a),结果发现,该操作可以显著抑制排尿行为,减少排尿反应,延长第一次排尿的潜伏期,以及尿液沉淀总量(与对照组相比,图7d)。
另外,研究人员利用Cre诱导表达的taCasp3(靶向神经元)触发L5投射神经元细胞凋亡(图7e),发现该操作导致小鼠排尿功能异常,且膀胱明显大于对照组(图7f-j)。再次证明大脑M1区L5皮层锥体神经元在排尿过程的重要作用。
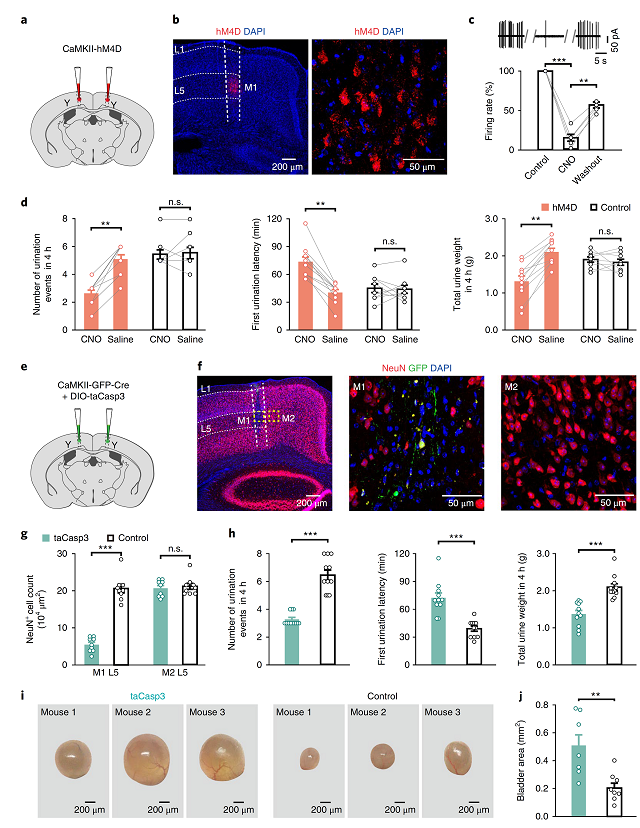
图7 沉默或杀掉M1区L5神经元会削弱排尿
排尿功能障碍性疾病是指各种原因引起的排尿异常,以尿失禁、尿潴留、尿频尿急、排尿困难等为主要症状的症候群,是泌尿外科常见的疾病之一。本实验首次发现L5皮层神经元投射到PMC诱发排尿动作的神经回路机制,极大提高了人们对该领域的认知,揭示了皮层排尿环路,为治疗排尿功能障碍相关疾病提供了新的思路。
此外,和元生物 有幸提供实验中使用的大量AAV工具病毒,从神经环路到光遗传、化学遗传学技术,到神经元消亡,用实际行动助力中国脑科学的发展。
和元生物 一直关注神经、代谢、肿瘤科学领域的重大研究进展,为神经生理、病理研究提供最新工具和研究方案,助力临床转化和基因治疗!
参考文献
1.Yao, J., Q. Zhang, X. Liao, Q. Li, S. Liang, X. Li, et al., A corticopontine circuit for initiation of urination. Nat Neurosci, 2018. 21(11): p. 1541-1550. DOI: 10.1038/s41593-018-0256-4.

扫一扫,反馈当前页面
和元生物