
【Neuron】不尽相同!详解美食与美酒令人心驰神往的神经环路机制
“莫笑农家腊酒浑,丰年留客足鸡豚。”
——陆游《游山西村》
图片来源:凡品网
不要笑话那酒浆浑浊,酒香中溢出的农家热情使人流连忘返。伴随着阵阵酒香、浓浓热情,人们大快朵颐,不亦乐乎。望着此情此景,不知道大家是否思考过这样一个问题:佳肴与美酒均可以让我们产生向往与满足感,那么食物与酒精作用的神经环路是否相同呢?

图片来源:昵图网
美食、美酒引起满足感的相关神经环路分为两部分——摄食环路与奖赏环路。摄食环路核心区域位于下丘脑弓状核,其中AgRP神经元与POMC神经元对摄食行为至关重要[1]。奖赏环路的核心为中脑多巴胺神经元[2],这些神经元释放的多巴胺参与食物和多种成瘾物引起的渴求行为。然而,对于食物与酒精是否通过相同机制作用于摄食、奖赏环路,以及摄食、奖赏环路之间如何相互作用,我们尚未可知。
图片来源:blog.ncase.me
2019年7月2日,《Neuron》杂志在线刊登了宾夕法尼亚大学J. Nicholas Betley研究组的最新重要工作[3],他们发现食物与酒精通过不同途径作用于摄食、奖赏环路,且摄食环路与奖赏环路之间存在正调控作用。该研究揭示食物与酒精对脑神经环路的区别性作用机制,极大提高了人们摄食、成瘾领域的认知。

J. Nicholas Betley教授
图片来源:University of Pennsylvania
结果
1.胃内酒精降低AgRP神经元活性近期研究显示,摄入卡路里抑制AgRP神经元[4]。酒精也含卡路里,那么是否亦能作用于下丘脑摄食环路呢?作者就此展开研究。
他们使用光纤钙信号记录方法,在Agrp-Cre或Pomc1-Cre小鼠的下丘脑弓状核(ARC)注射AAV-DIO-GCaMP6s并植入光纤,将小鼠饥饿处理(图1A-B)。他们发现灌胃摄入酒精后,小鼠AgRP神经元钙信号显著减弱,POMC神经元钙信号不变(图1C-I),表明灌胃摄入酒精抑制AgRP神经元而非POMC神经元。
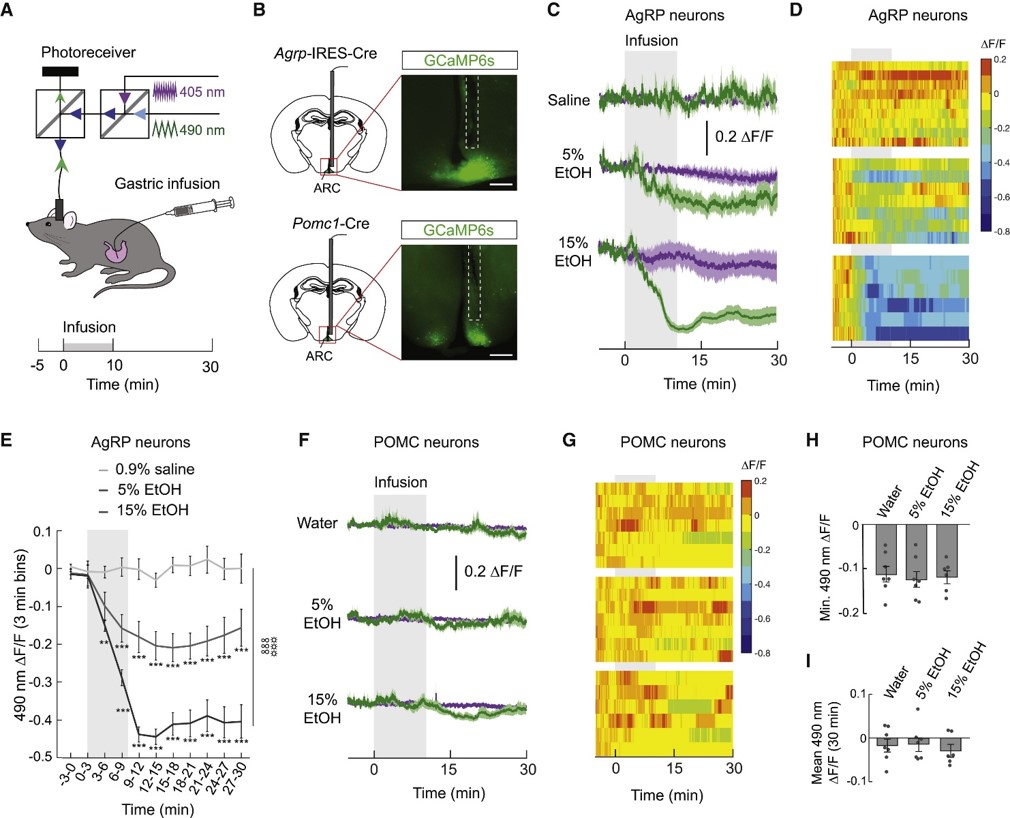
图1 灌胃摄入酒精抑制AgRP神经元
2.与蔗糖不同,酒精无法引起AgRP神经元的预期性反应生活中,酒精具有成瘾性,很多人会自发饮酒。那么,饮酒如何影响AgRP活性呢?作者就此展开进一步研究。
他们再次使用光纤钙信号记录方法,使小鼠饮酒(10%酒精)一周,发现小鼠再次摄入酒精15分钟后,其AgRP神经元活性降低(图2A-G)。
然后,作者探究酒精摄入是否影响AgRP神经元的预期性反应。通常情况下,小鼠摄入糖水后,AgRP神经元活性随即降低(图2H-I)。但是,对于未摄入糖水的小鼠,它们在第一次舔舐糖水前,AgRP神经元不会有任何反应;摄入过糖水的小鼠在舔舐糖水前,AgRP神经元活性已经开始下降,舔舐糖水后降至更低,直到平台;而饮酒一周的小鼠在舔舐酒精前,AgRP神经元无任何反应(图2J-L)。此外,光激活AgRP神经元增加小鼠的摄糖量,而不改变其摄酒量(图2M-Q)。
以上结果表明,摄入蔗糖使AgRP神经元产生预期性反应,而酒精并不能。
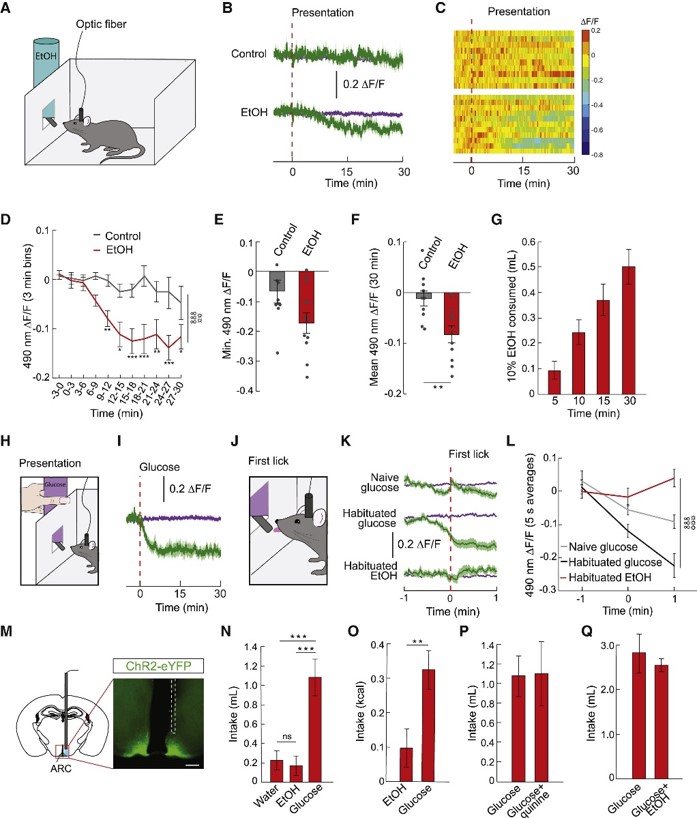
图2 与蔗糖不同,酒精无法引起AgRP神经元的预期性反应
3.酒精抑制AgRP神经元不依赖于迷走神经上文已知,酒精可抑制AgRP神经元,但不能引起预期性反应。了解现象后,便是相关机制的探索。
对于酒精与营养物质的不同作用机制,作者首先想到的是脑-肠之间的迷走神经信号。营养物质可作用于胃肠道使之释放胆囊收缩素(CCK)、肽YY(PYY)等满足感信号分子,这些信号分子可快速、强效抑制AgRP神经元[4]。为探究迷走神经是否介导满足感信号分子对AgRP神经元的调控作用,作者切断小鼠膈下迷走神经(VGX),CCK不再抑制小鼠进食,肠内神经也不再接受迷走神经背核(DMX)的投射(图3A-C)。他们发现VGX小鼠AgRP神经元不再被腹腔注射的CCK、PYY抑制(图3D-G),也不再被灌胃摄入的脂肪抑制(图3H-J),但依然被灌胃摄入的酒精抑制(图3H,I,K)。
以上结果表明,满足感信号分子与高卡路里食物对AgRP神经元的抑制性作用由迷走神经介导,而酒精抑制AgRP神经元不依赖于迷走神经。
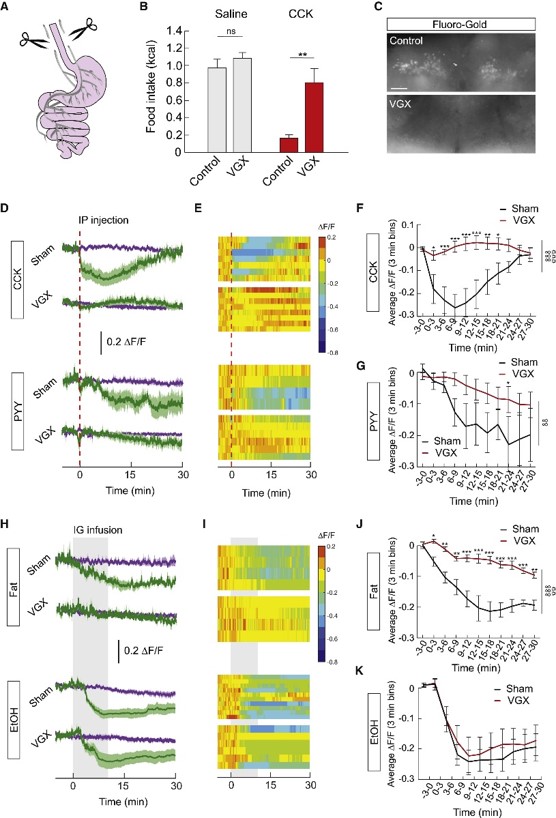
图3 酒精抑制AgRP神经元不依赖于迷走神经
4.酒精减少禁食小鼠的摄食行为然后,为探究酒精对摄食行为的影响,作者灌胃给予小鼠15%酒精,发现24小时内禁食小鼠的摄食量显著降低,而饱餐小鼠的摄食量无变化(图4A-D)。即使连续给予饱食小鼠2g/kg酒精2周,小鼠依然无动于衷,摄食量无任何变化(图4E-F)。因此,对于饥饿小鼠,摄入酒精会减少摄食。而对于饱餐的正常小鼠,摄入酒精并不影响摄食行为。
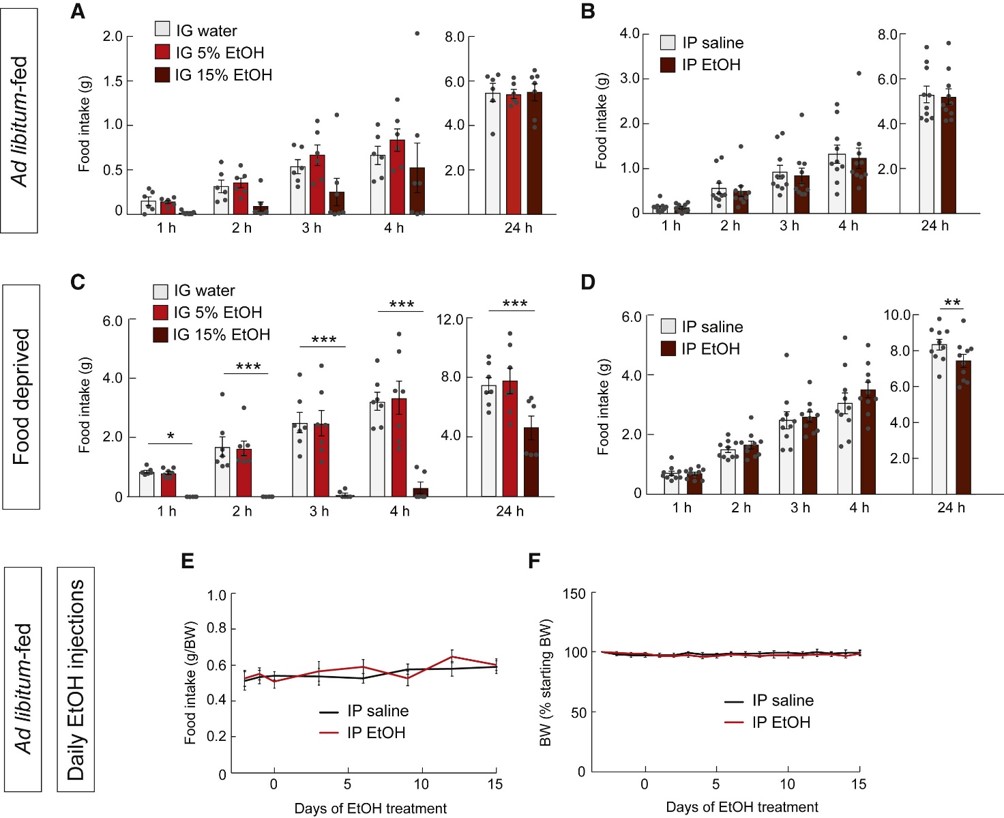
图4 酒精减少禁食小鼠而非饱食小鼠的摄食行为
5.酒精与食物区别作用于奖赏系统再然后,为探究酒精对奖赏系统的影响,作者在Slc6a3-Cre小鼠的腹侧被盖区(VTA)中注射AAV-DIO-GCaMP6f,发现灌胃给予小鼠酒精激活VTA多巴胺(DA)神经元,给予脂肪亦然,给予水则会抑制VTA DA神经元(图5A-F)。此外,酒精可提高伏隔核(NAc)脑区多巴胺释放水平,而脂肪不能(图5G-L);脂肪可提高背侧纹状体(DS)脑区多巴胺的释放水平,而酒精不能(图5M-R)。以上结果表明,酒精通过VTA DA-NAc环路介导奖赏行为,高卡路里食物通过VTA DA-DS环路介导奖赏行为。
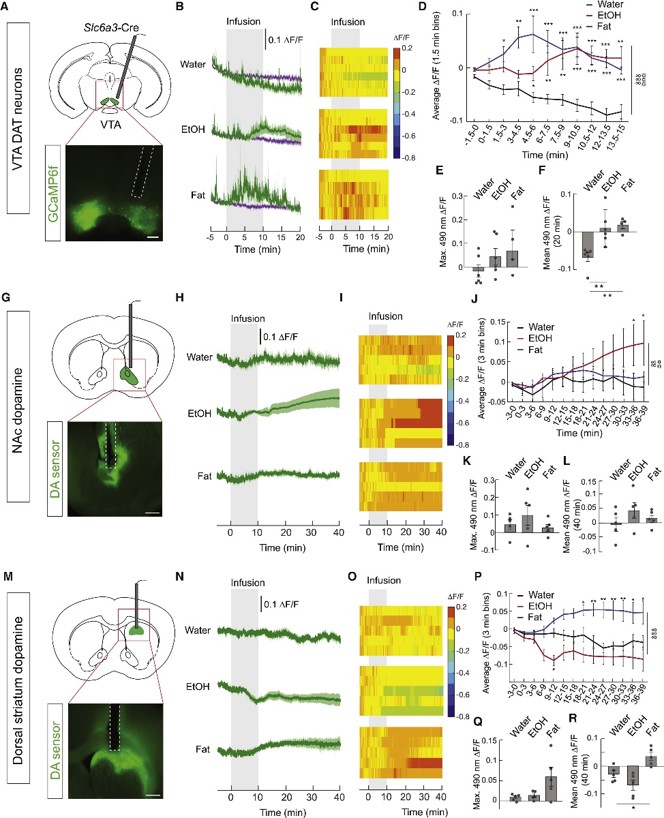
图5 酒精与食物区别作用于中脑多巴胺奖赏环路
6.其它成瘾性药品对下丘脑摄食环路与中脑奖赏环路的影响上文结果表明,酒精并非通过卡路里成分抑制下丘脑摄食环路,那么,其它成瘾物呢?接下来,作者就多种成瘾性药品对下丘脑摄食环路的影响展开探究。他们记录AgRP与POMC神经元的钙信号,发现腹腔注射可卡因、安非他明与尼古丁降低AgRP与POMC神经元活性,而腹腔注射盐、糖、咖啡因不会(图6A-H),表明营养物质需通过胃肠道作用于大脑,而成瘾性药品通过其它机制直接作用于大脑。
奖赏环路方面,腹腔注射盐、糖、咖啡因不影响VTA DA神经元活性和NAc多巴胺释放量;而腹腔注射可卡因、安非他明与尼古丁均会提高NAc多巴胺释放水平,尽管可卡因抑制VTA DA神经元,尼古丁激活VTA DA神经元,安非他明不影响VTA DA神经元活性(图6I-P)。
综上,成瘾性药品均可作用于摄食环路与成瘾环路,且与食物的作用机制不尽相同。
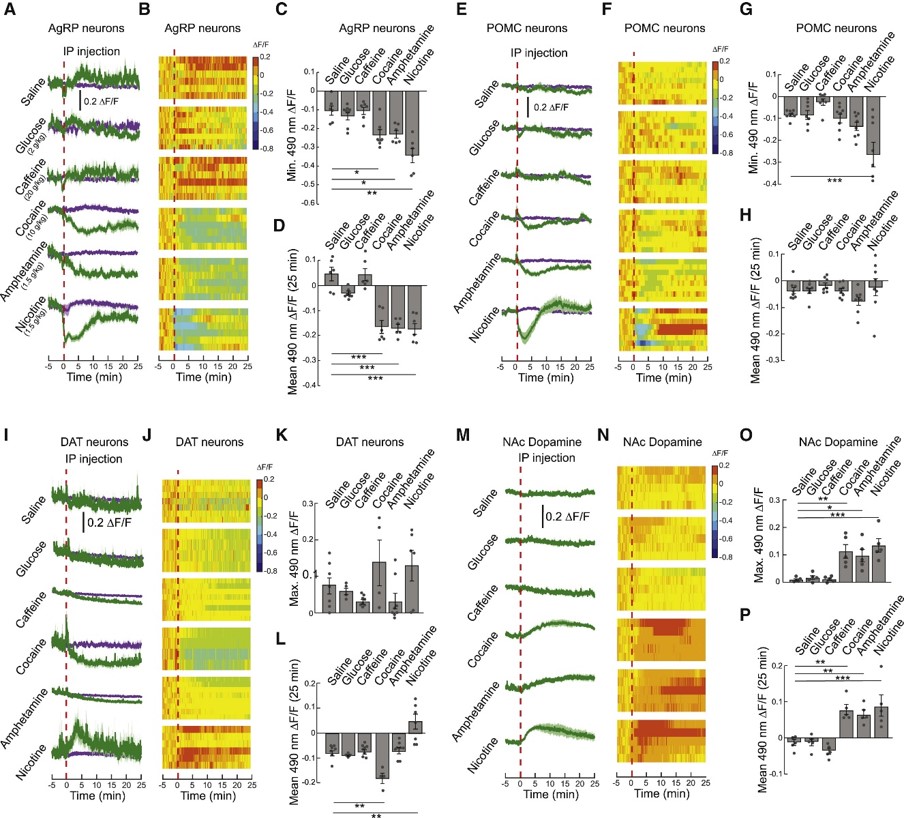
图6 其它成瘾性药品对下丘脑摄食环路与中脑奖赏环路的影响
7.摄食环路与奖赏环路之间的相互作用最后,作者探究摄食环路与奖赏环路之间的相互作用。首先是摄食环路对奖赏环路的调控作用。他们在Agrp-Cre小鼠的ARC中注射AAV-DIO-hM3D,在NAc注射DA指示剂并植入光纤,发现化学激活AgRP神经元后小鼠的摄食行为增加,且多巴胺释放量增加(图7A-F)。此外,激活AgRP神经元后,酒精与尼古丁引起的多巴胺释放量也增加(图7G-L)。
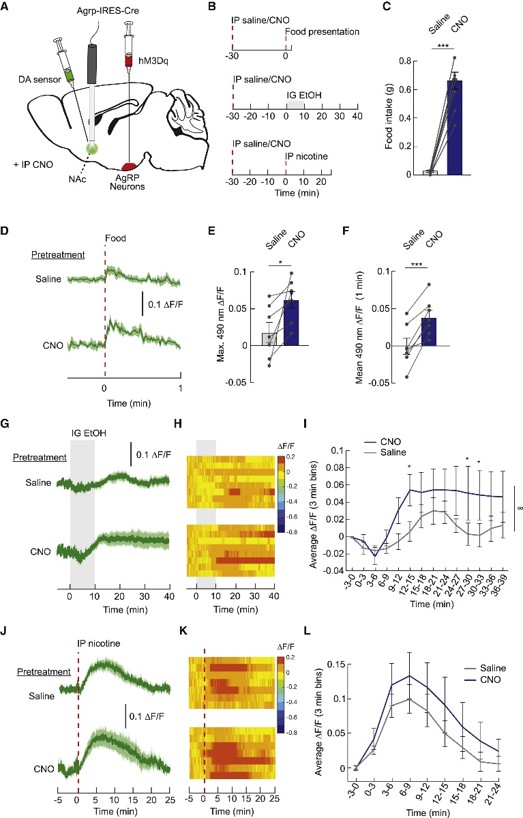
图7 激活摄食环路强化奖赏环路的反应
接着,是奖赏环路对摄食环路的调控作用。他们在Agrp-Cre小鼠的ARC中注射AAV-DIO-GCaMP6s并植入光纤,通过腹腔注射多巴胺受体拮抗剂降低多巴胺信号强度。他们发现多巴胺信号强度减弱后,灌胃给予脂肪引起的AgRP神经元抑制效应降低(图8A-E),酒精与尼古丁对AgRP神经元的抑制效应也降低(图8F-K)。
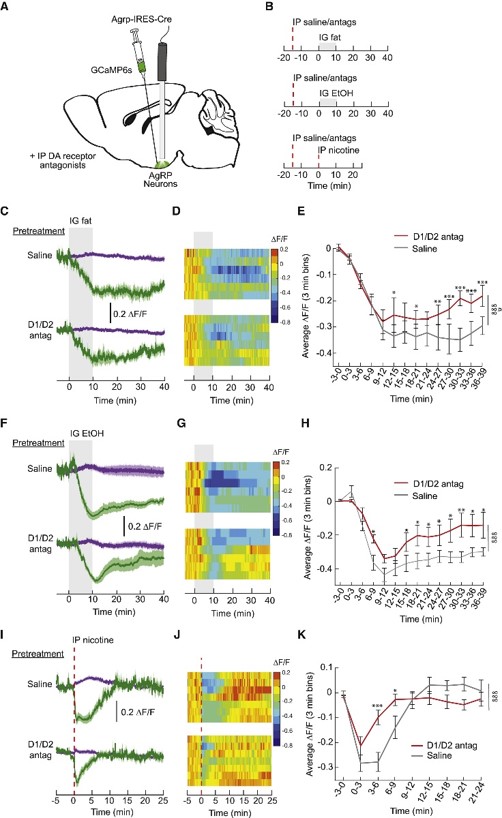
图8 抑制奖赏环路弱化摄食环路的反应
总结
酒精与其它成瘾物会影响摄食行为,饥饿程度也会影响机体对成瘾物的渴求行为。然而,对于食物与成瘾物对下丘脑摄食环路与中脑奖赏环路的作用机制是否相同,以及摄食环路与奖赏环路相互之间如何相互调控,我们知之甚少。本篇文章结合钙信号记录、多巴胺信号记录、膈下迷走神经切断术、光遗传学、化学遗传学等多种方法发现食物与成瘾物通过不同途径作用于摄食环路和奖赏环路,食物需要迷走神经,而成瘾物不需要。此外,他们发现摄食环路和奖赏环路之间具有正相互作用。这项研究阐释了食物与成瘾物作用于脑神经系统的环路机制(图9),让我们了解摄食与饮酒的本质区别,也为临床治疗药物成瘾相关疾病提供有力支持!
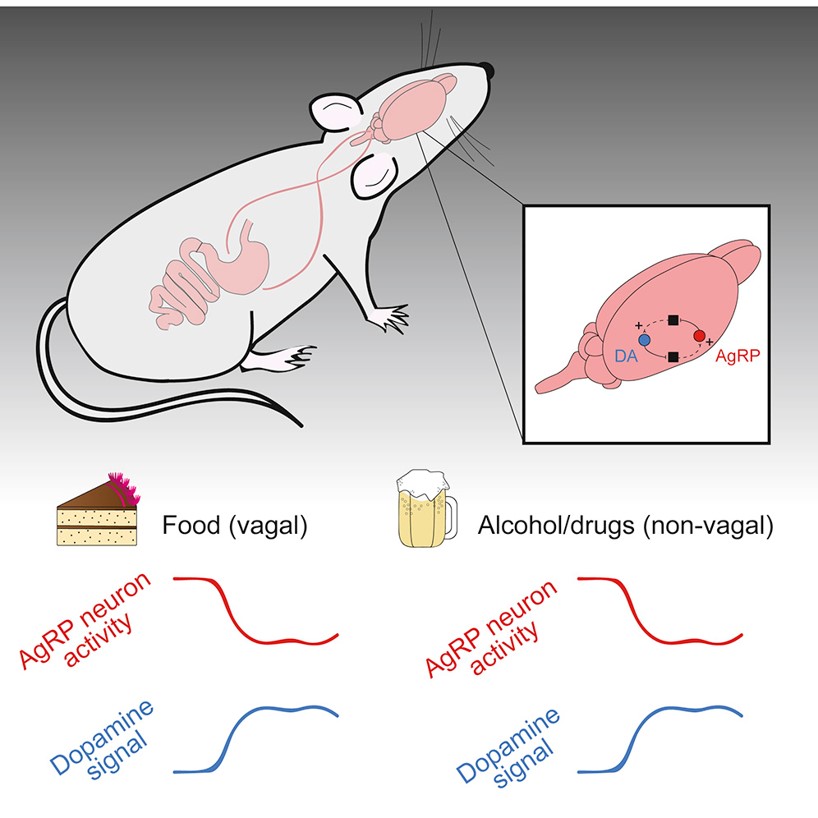
图9 参与摄食和饮酒的神经环路模式图
宾夕法尼亚大学通过钙信号记录、多巴胺信号记录、光遗传学、化学遗传学等技术手段阐释食物与酒精区别性作用于脑神经系统的环路机制。和元病毒库中有丰富多样的病毒载体,除了文中用到的GCaMP6和DA sensor外,和元病毒库还有最新的jGCaMP7、GCaMP-X、多彩的XCaMP系列等钙离子指示剂,以及NE sensor和ACh sensor等神经递质探针,质量严格把关,经由多实验组验证,欢迎大家选购!

OBiO和元生物 一直致力为神经科学研究提供整体研究方案,从标记、示踪、基因操作、生理操作到观察,提供病毒包装、动物模型构建、病理研究等一站式服务。用实际行动助力中国脑科学的发展!
参考文献
[1].Betley, J.N., et al., Neurons for hunger and thirst transmit a negative-valence teaching signal. Nature, 2015. 521(7551): p. 180-185.
[2].Cohen, J.Y., et al., Neuron-type-specific signals for reward and punishment in the ventral tegmental area. Nature, 2012. 482(7383): p. 85-8.
[3].Alhadeff, A.L., et al., Natural and Drug Rewards Engage Distinct Pathways that Converge on Coordinated Hypothalamic and Reward Circuits. Neuron, 2019.
[4].Beutler, L.R., et al., Dynamics of Gut-Brain Communication Underlying Hunger. Neuron, 2017. 96(2): p. 461-475 e5.

扫一扫,反馈当前页面
和元生物