
【Nat Methods】人工智能!机器学习引导无创光遗传学技术
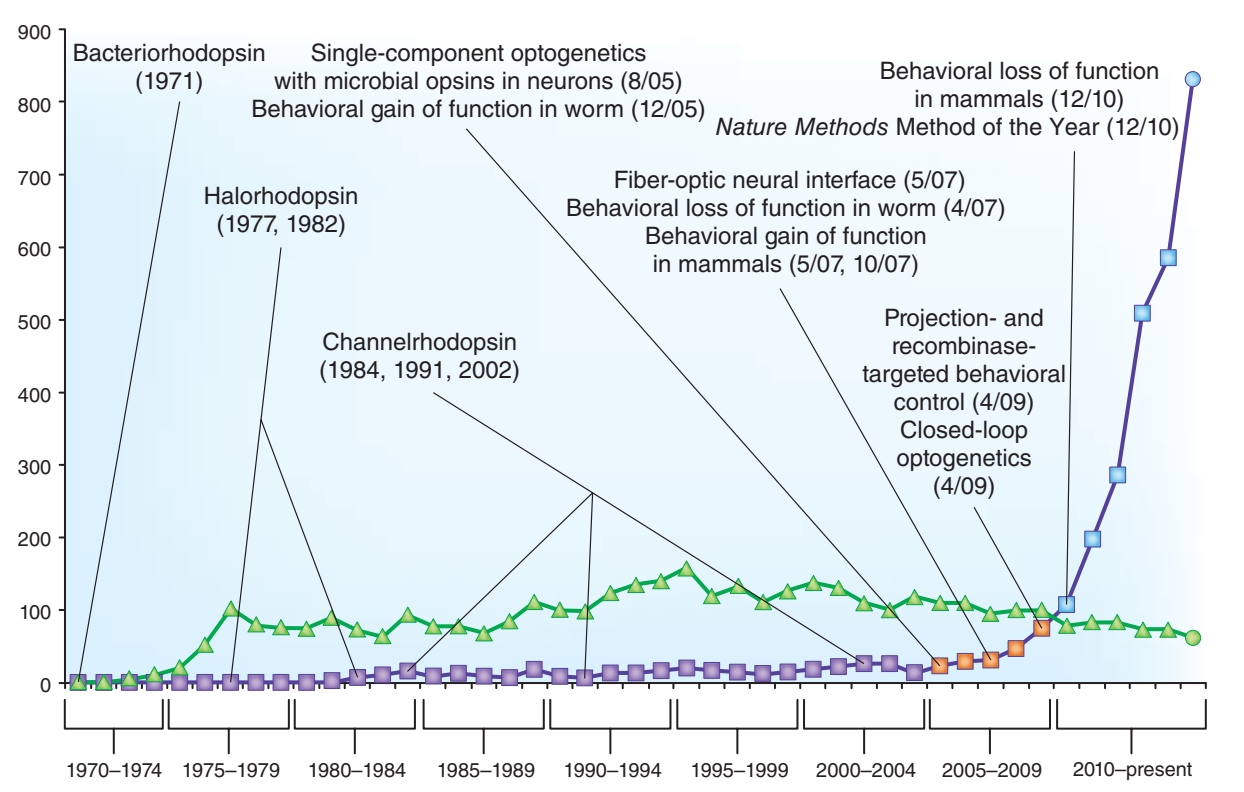
截至2015年,光遗传学及视蛋白相关文献发表数量图片来源:Nature Neuroscience[1]
光遗传学技术对神经元活性的操控依赖于光敏感通道蛋白(Channelrhodopsins, ChRs),在神经元中表达ChRs可以实现光控神经元激活或光控神经元抑制效应,这些ChRs已广泛应用于神经科学研究[2, 3]。
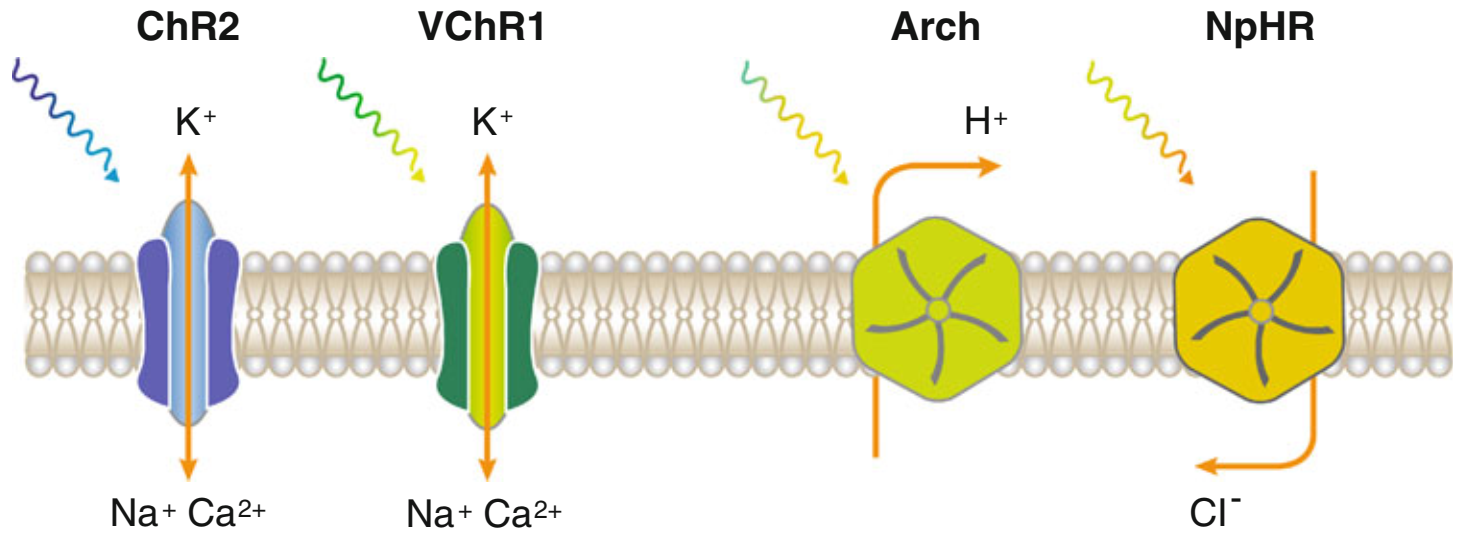
图片来源:Molecular Genetics and Genomics[4]
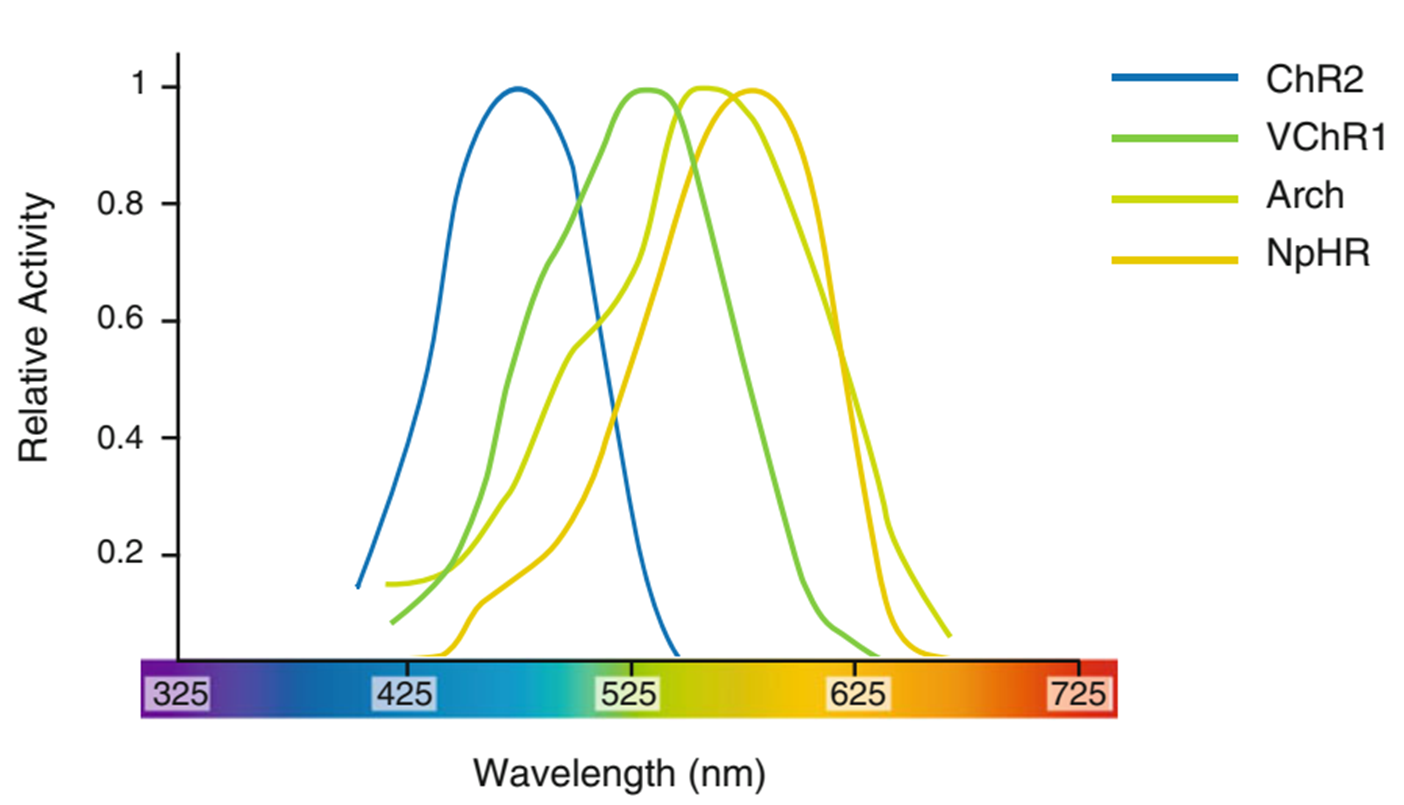
但是,现阶段常用的ChRs并非完美无瑕,它们的缺陷限制了光遗传学技术的应用广度。首先,在可见光范围内,这些ChRs具有广泛的激活光谱,即激活ChRs的可见光缺乏波长特异性。其次,ChRs需要足够强(约1 mW/mm2)的光照方可激活。引起一个神经元产生动作电位,需要同时激活105-106个ChRs[5]。再次,不同ChRs的激活延迟时间不同,我们需要优化ChRs的动力学特性。最后,光遗传学技术需要植入光纤,会引起组织损伤。


2019年10月14日,《Nature Methods》杂志在线刊登了加州理工学院Frances H. Arnold研究组的最新重要工作[8],他们通过高斯过程筛选出3种高性能ChRs——ChRger1-3,其中ChRger2可实现无创光操控神经元这一过程。该研究将机器学习应用于分子筛选过程,拓宽了光遗传学的应用广度,极大促进了神经科学领域的研究进展。

图片来源:Princeton University
结果
1.机器学习引导ChRs的优化过程
首先,为优化ChRs的光电流强度、波长特异性和动力学特性,作者通过高斯过程分类与高斯过程回归模型,在120000种理论上存在的ChRs中筛选出上述三类特性俱佳的28种ChRs(图1a-d)。然后,作者将这28种ChRs表达于HEK细胞并通过膜片钳电生理手段检验其性质是否符合预期。他们发现,这些ChRs的性质均与高斯过程预测的性质高度一致(图1e-f),表明此机器学习方法可应用于ChRs的优化过程。
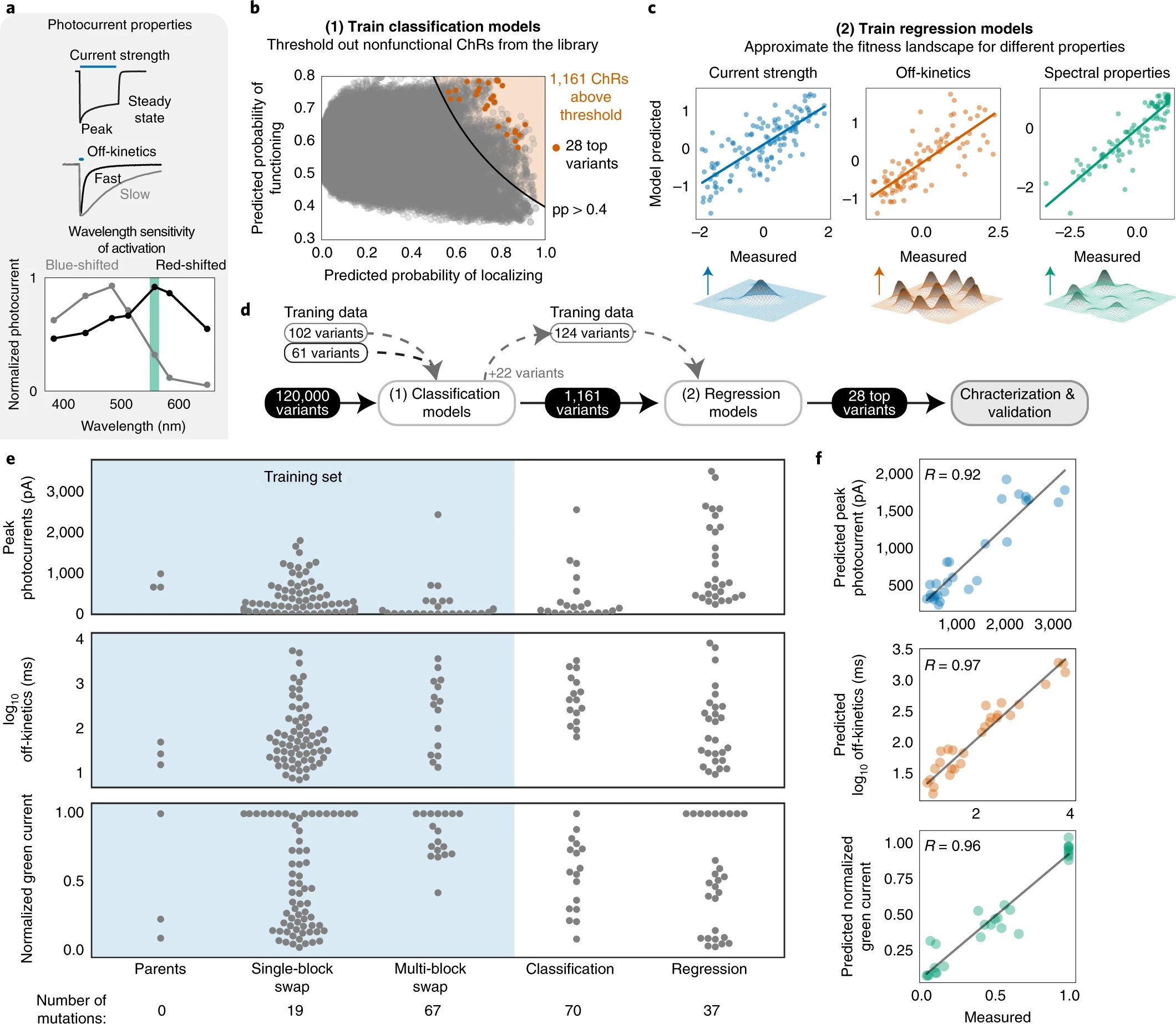
图1 机器学习引导ChRs的优化过程
2.机器学习预测的ChRs具有优异的功能特性
接着,作者进一步检验上述28种ChRs的性质。他们将这些ChRs表达于HEK细胞,并使用膜片钳电生理技术记录这些细胞。他们发现,其中12种ChRs具有极高的光电流强度,2种ChRs具有极短的(~12 ms)激活延迟时间,4种ChRs具有极长的(~17 s)激活延迟时间,1种ChR的激活光谱比较狭窄(图2)。这些ChRs在这几方面的性质显著优于现存的所有ChRs,其中ChR_9_4、ChR_25_9和ChR_11_10的电导率最高。作者将其重新命名为ChRger1、ChRger2和ChRger3,并对这三种ChR在神经元中的功能特性展开进一步探究。
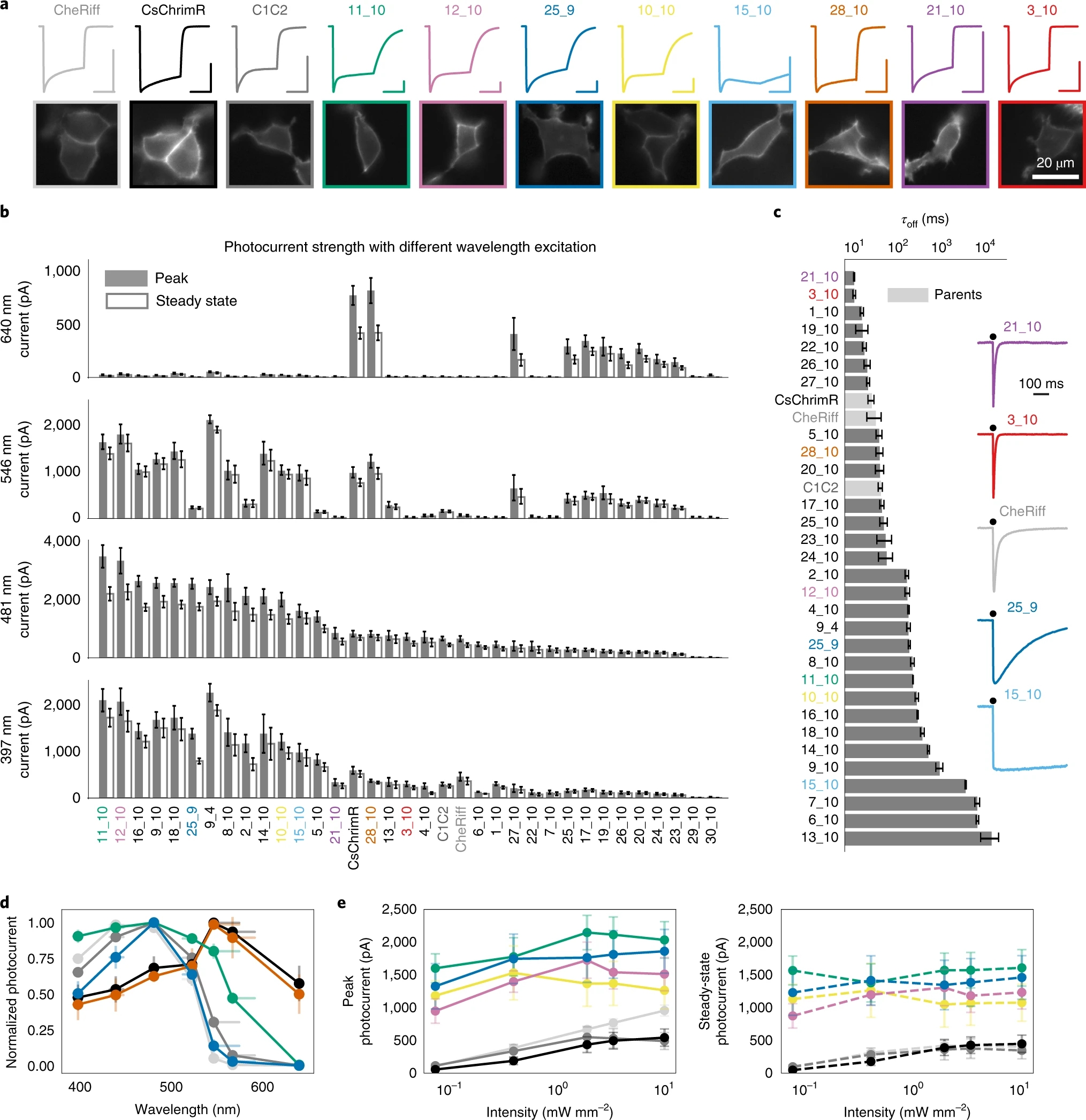
图2 机器学习预测的ChRs具有优异的功能特性
3.ChRger1-3功能特性的在体验证
在神经科学领域的研究中,ChRs需要在神经元中行使其功能。为进一步探究ChRger1-3在神经元中的功能特性,作者通过AAV将其表达于培养的神经元(图3a),并使用膜片钳电生理技术记录这些神经元。他们发现,与CoChR和ChR2相比,ChRger1-3在更低的光强条件下即可介导神经元的激活过程(图3b-f)。
然后,作者在体验证ChRger1-3在神经元中的功能特性。他们在小鼠前额叶皮层中注射rAAV-PHP.eB[9]以实现ChRger1-3或ChR2在神经元中的表达,并使用膜片钳电生理技术记录这些ChRs阳性神经元。他们发现,激活ChRger1-3需要的光照强度更低,且同等光照强度条件下,ChRger1-3介导的光电流强度更高(图3g-h),表明ChRger1-3的光敏感度显著高于ChR2。 再然后,作者探究ChRger1-3能否在系统表达的条件下行使其功能。他们在小鼠中静脉注射rAAV-PHP.eB以实现ChRger1-3或ChR2的系统表达,并使用膜片钳电生理技术记录这些ChRs阳性神经元。他们发现在光照条件下,几乎所有ChRger1-3阳性神经元均会发放,而只有4%的ChR2阳性神经元发放(图3i-l)。此外,在高频光照条件下,ChRger2表现最佳(图3m-n),于是作者关于ChRger2的应用广度展开进一步探究。
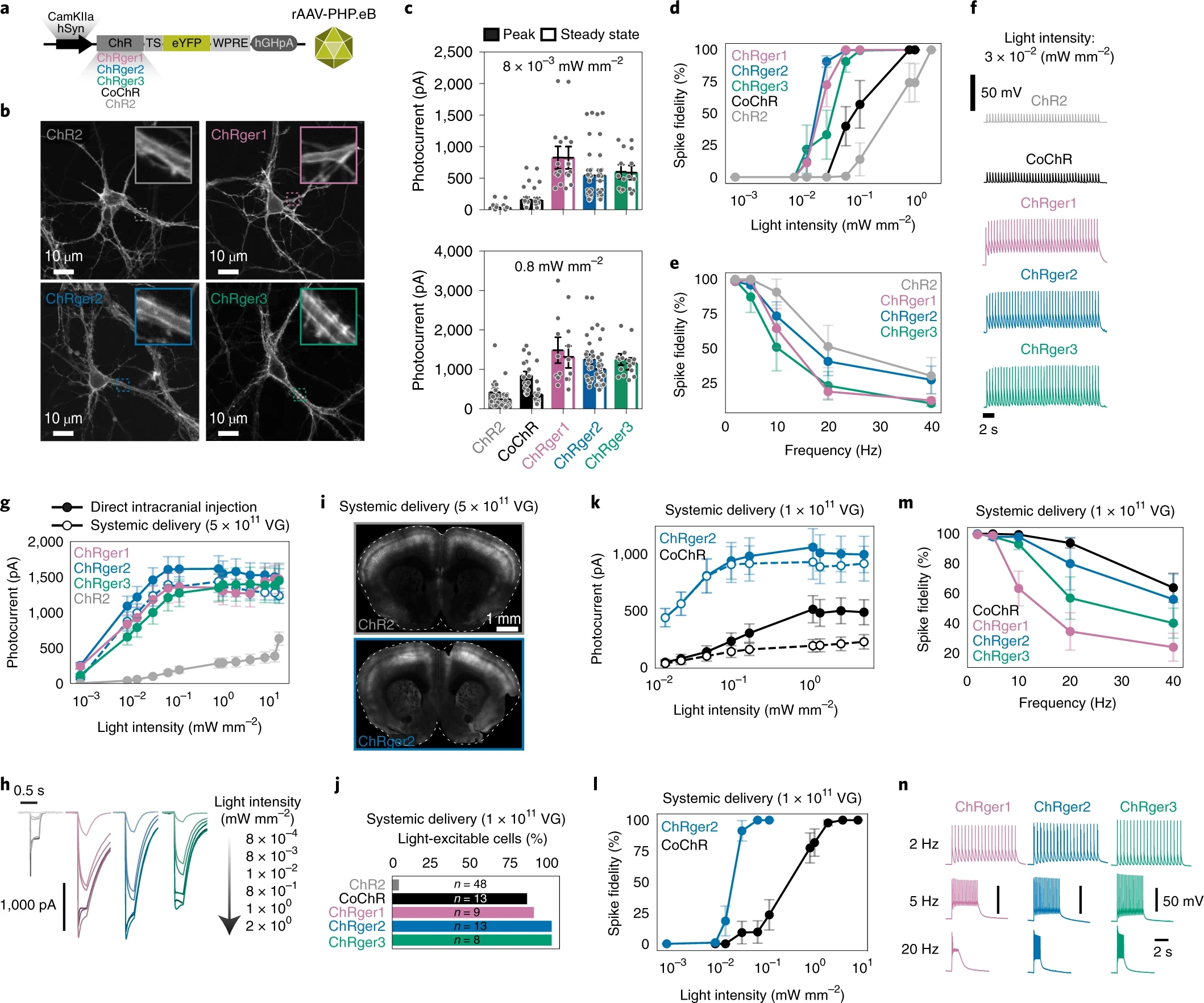
图3 ChRger1-3功能特性的在体验证
4. ChRger2介导无创光控神经元过程
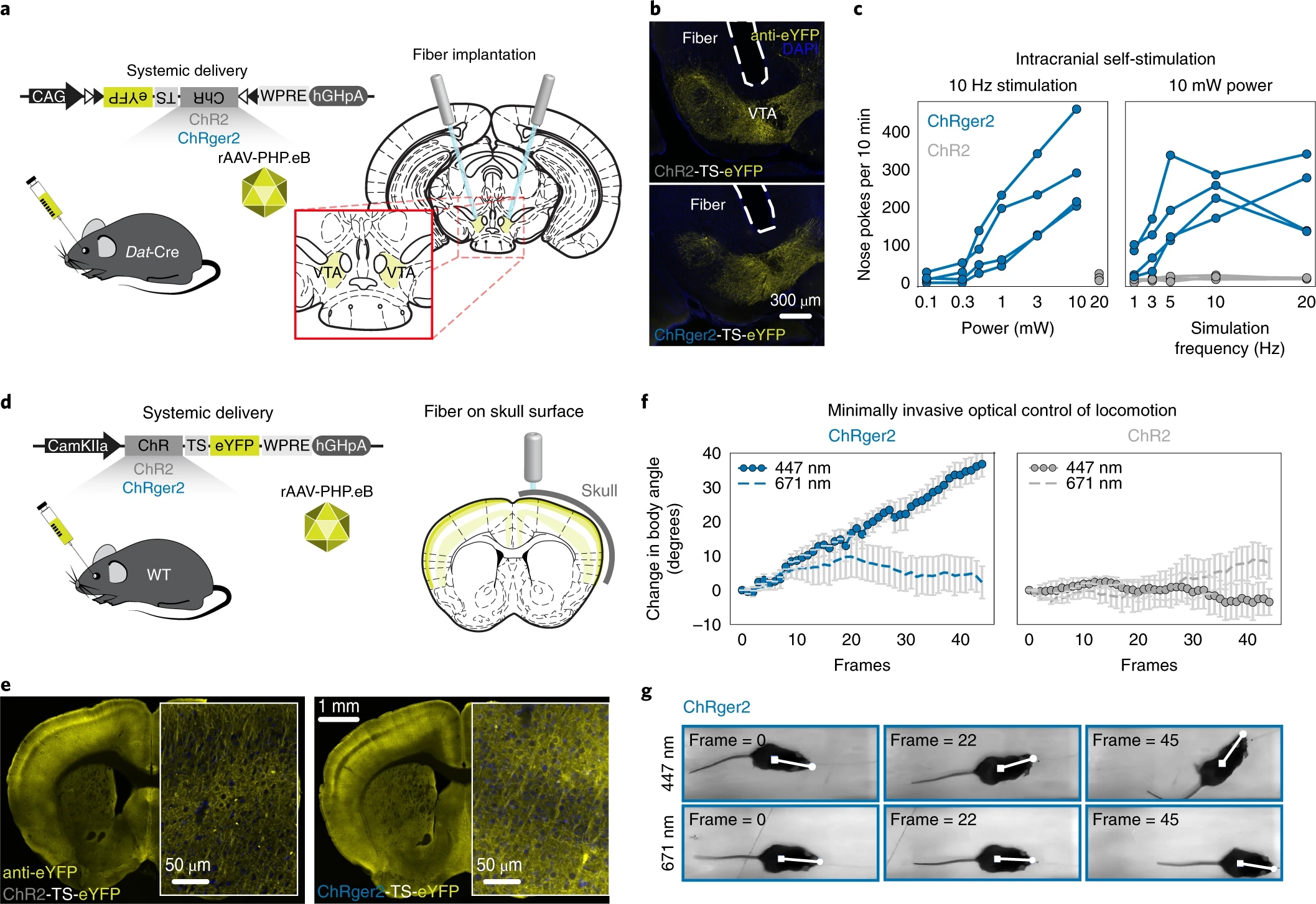
为进一步探究ChRger2在系统表达的条件下的功能,他们在Dat-Cre小鼠中静脉注射rAAV-PHP.eB包被的AAV-DIO-ChRger2或AAV-DIO-ChR2并植入光纤。他们发现光激活ChRger2阳性神经元诱发小鼠产生大量奖赏行为,而光激活ChR2无任何影响(图4a-c),表明在系统给药条件下,ChRger2可介导足够强的光电流以诱发相应功能,而ChR2不能。
最后,作者探究ChRger2在无创光控神经元过程中的应用。他们在小鼠中静脉注射rAAV-PHP.eB包被的AAV-hSyn-ChRger2,在第二运动皮层上方颅骨表面放置光纤。他们发现447 nm蓝色激光诱发小鼠产生偏转运动,而671 nm红色激光不能(图4d-g),表明ChRger2可充分介导无创光控神经元过程。
参考文献
1.Deisseroth, K., Optogenetics: 10 years of microbial opsins in neuroscience. Nature Neuroscience, 2015. 18: p. 1213.
2.Deisseroth, K. and P. Hegemann, The form and function of channelrhodopsin. Science, 2017. 357(6356).
3.Yizhar, O., et al., Optogenetics in neural systems. Neuron, 2011. 71(1): p. 9-34.
4.Rein, M.L. and J.M. Deussing, The optogenetic (r)evolution. Mol Genet Genomics, 2012. 287(2): p. 95-109.
5.Lin, J.Y., A user's guide to channelrhodopsin variants: features, limitations and future developments. Exp Physiol, 2011. 96(1): p. 19-25.
6.Bedbrook, C.N., et al., Machine learning to design integral membrane channelrhodopsins for efficient eukaryotic expression and plasma membrane localization. PLoS Comput Biol, 2017. 13(10): p. e1005786.
7.Romero, P.A. and F.H. Arnold, Exploring protein fitness landscapes by directed evolution. Nat Rev Mol Cell Biol, 2009. 10(12): p. 866-76.
8.Bedbrook, C.N., et al., Machine learning-guided channelrhodopsin engineering enables minimally invasive optogenetics. Nat Methods, 2019.
9.Chan, K.Y., et al., Engineered AAVs for efficient noninvasive gene delivery to the central and peripheral nervous systems. Nat Neurosci, 2017. 20(8): p. 1172-1179.

扫一扫,反馈当前页面
和元生物