
【WHO慢病毒整合拷贝数标准品】之标定方法解读篇
喜报!和元生物 作为国内领先的基因治疗病毒载体CDMO企业,参与世界卫生组织(WHO)牵头的、全球首个基于基因治疗用慢病毒的标准品标定项目,并顺利完成任务,为全球基因和细胞治疗的发展贡献自己的核心力量!
近年来,随着Kymriah, Yescarta 以及 Strimvelis等细胞治疗产品陆续推上市场,慢病毒作为细胞装载CAR过程的关键中间载体,其整合拷贝数测定标准的确立更是亟待解决的关键问题。
目前,慢病毒整合拷贝数测定方法主要是定量PCR,该方法由于受标准品的选择、引物序列的选择以及反应条件等影响,导致不同实验室之间检测方法及检测灵敏度存在巨大差异,这使其在临床试验、检测以及不同实验室之间的数据难以进行比较。

WHO-CS633项目是由WHO及英国国家生物制品检定所(National Institute for Biological Standards and Control,NIBSC)发起,通过在全球范围内不同实验室对慢病毒感染后的HEK293T细胞基因组DNA进行拷贝数标定,进而确定慢病毒整合拷贝数国际标准品。该项目主要采用TaqMan qPCR,SYBRGreen qPCR及ddPCR(digital PCR)三种方法对5份冻干基因组DNA进行拷贝数的检测。

5种基因组DNA样品编号分别为A/E(A和E是相同的样品)、B、C和D,包含0、低、中或高不同拷贝数,按下表(Table 1)说明进行制备后,使用qPCR对A/E、B、C、C1、C2、C3、C4和D 8个样品及ddPCR对 A/E、B、C和D 4个样品进行测试。其中qPCR方法采用同一个已知拷贝数的DNA标准品“NIBSC DNA standard”进行梯度稀释制备慢病毒基因与内参基因(housekeeping,HK)标准曲线,从而计算慢病毒基因拷贝数与内参基因拷贝数。
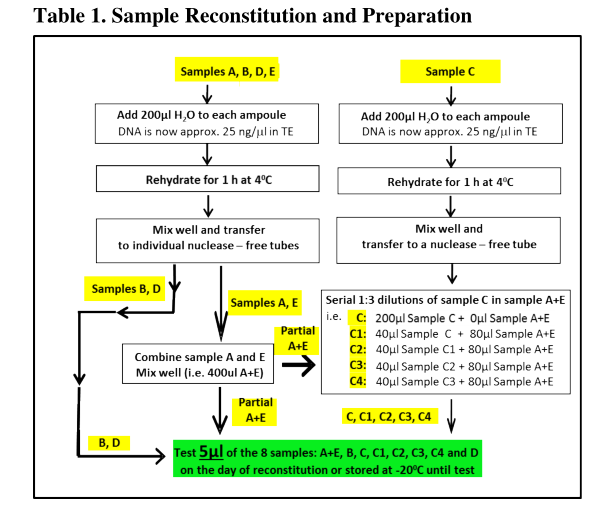
每种方法由不同的操作员分别于3天进行3次独立的实验,收集各实验室样品的原始数据和定量结果(例如qPCR Ct值或ddPCR液滴计数)进行分析。
此次标定主要基于TaqMan qPCR、SYBRGreen qPCR和ddPCR 3种方法,共筛选收集了全球13个国家/地区的31个实验室的检测结果。
其中,29个实验室采用TaqMan qPCR、13个实验室采用SYBRGreen qPCR、11个实验室采用ddPCR方法来评估慢病毒整合拷贝数(所有研究均使用参与标定实验室的试剂和设备进行),最终获得 60 组慢病毒基因组拷贝数检测结果(包括 31 组TaqMan qPCR、15 组SYBRGreen qPCR和14组dd PCR数据),共计66名实验人员参与到此次标定工作。
对来自不同实验室的38组qPCR和14组ddPCR的有效数据进行分析,结果表明各实验室间qPCR 测定 (n=38)的 GCV 值在14.9%-20.2%之间,样品B、C、D的LV copies/cell平均值分别为1.42(1.37 - 1.48)、8.76 (8.26 - 9.29)和10.67(10.05 -11.33),TaqMan qPCR与SYBRGreen qPCR结果相对一致,而两种ddPCR(simplex ddPCR和multiplex ddPCR)之间存在差异(Table 2 和Figure 1)。
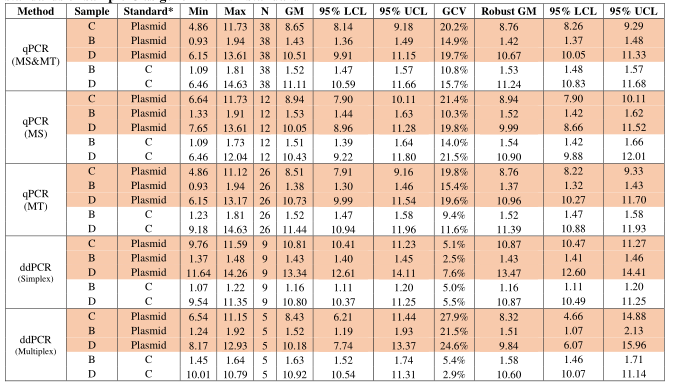

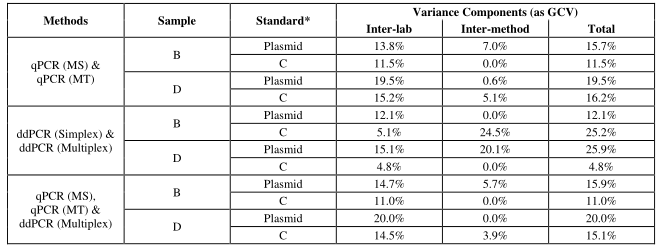
用梯度稀释的样品C作为标曲,对未知样品B和D进行计算。相较质粒标准品,样品B和D qPCR结果的GCV值降低(样品B的GCV值从15.7%降至11.5%,样品D从19.5%降至16.2%);而对于ddPCR结果,样品D的GCV值从25.9%降至4.8%,但样品B的GCV值从12.1%增加到25.2%。
从qPCR和ddPCR(Multiplex)综合分析,样品B和样品D的GCV值均存在降低(Table 3和Figure 1)。
此外,本项目对样品B、C和D进行测序及含量测定(Nanodrop和QuBit),这对分析慢病毒的整合位点和基因组DNA定量提供了支持。
整合分析来自全球31个不同实验室的数据,整体研究数据质量较高(qPCR:38次有效数据/ 46次检测实验,ddPCR:所有数据均有效),qPCR检测的单细胞慢病毒拷贝数有效数据在各实验室间的GCV波动范围较小,而ddPCR数据之间以及与qPCR数据对比存在差异。
利用梯度稀释的样品C作为标曲,对未知样品B和D进行计算。相较于质粒标准品,样品B和D在实验室间变异性减小,故使用样本C(基因组DNA)作为慢病毒整合拷贝数国际标准品,减少了不同实验室使用质粒DNA标准品存在的潜在差异,可实现慢病毒整合拷贝数检测在临床试验、检测以及实验室之间的标准化。
同时,该项目对用于慢病毒整合拷贝数国际标准品基因组DNA的制剂处方进行了筛选,并考察了8个月以上的稳定性。研究表明,基因组DNA在经过长期(-20℃条件下)、高温(56℃)、冻融操作后,其慢病毒整合拷贝数没有显著变化,表明该基因组DNA制剂可以在-20°C条件下长期储存并保持稳定。
和元生物 有幸作为国内基因治疗病毒载体CDMO企业参与到该项慢病毒标准品标定工作中,为推动慢病毒在临床试验、检测以及不同实验室之间的数据传递与共享贡献力量。
不仅从中获取经验、展现中国力量,和元生物 也同时为广大基因治疗研发企业带来全球化视角和国际病毒生产标准,真正推动基因疗法上市应用。

扫一扫,反馈当前页面
和元生物