乳腺癌已成为全球癌症相关死亡的主要原因,也是女性最常见的癌症。大约20%的乳腺癌患者HER-2过表达,因此预后较差。目前,靶向HER-2胞外区域的人源化单克隆抗体曲妥珠单抗已是HER-2阳性乳腺癌的替代治疗方案。然而,只有一小部分转移性患者对曲妥珠单抗有反应,大约60%的患者在最初反应后产生耐药性。
外泌体是一种释放到组织液中且大小为20-150nm的具膜小泡,小泡中含有来自供体细胞的蛋白质、脂质、编码和非编码RNAs,这些分子可以被其他细胞所摄取。有文献报道,有些lncRNAs在乳腺癌曲妥珠单抗耐药过程中起重要作用。然而,外泌体包裹的lncRNAs是否参与了耐药作用尚不清楚,需要进一步研究。
近日,海南省人民医院和郑州大学附属第一医院共同在《Molecular Cancer》上发表论文,阐述了外泌体lncRNA(AFAP1-AS1)可以与AUF1结合,促进ERBB2翻译,从而诱导曲妥珠单抗耐药。
和元生物可提供从实验设计、外泌体分离、外泌体鉴定、外泌体高通量检测、外泌体示踪到体内外功能验证的整体服务。
实验结果:
1.LncRNA AFAP1-AS1在曲妥珠单抗细胞中上调并被H3K27ac激
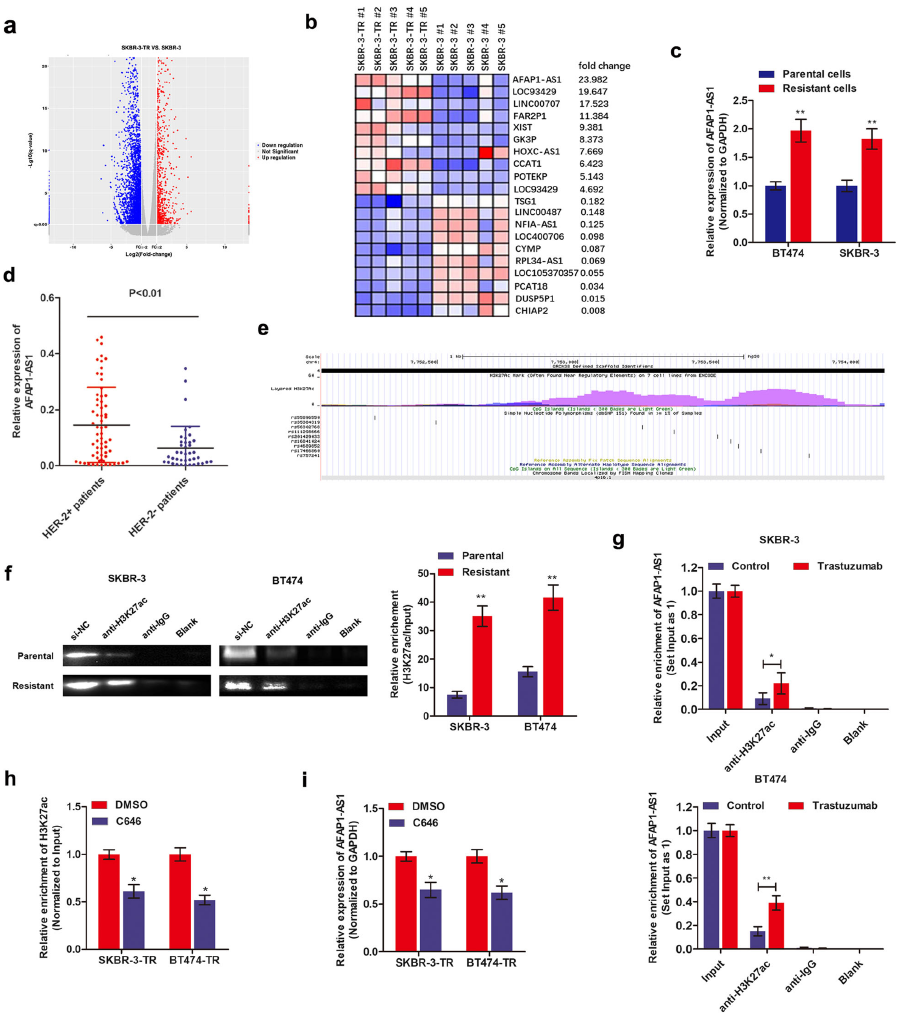
作者首先建立了乳腺癌的曲妥珠单抗耐药株(SKBR-3-TR和BT474-TR),再将SKBR-3-TR和SKBR-3亲本细胞进行高通量测序,根据火山图、表达倍数变化等生物信息学分析发现AFAP1-AS1在这两种类型细胞中显著失调。随后,作者用qRT-PCR验证了AFAP1-AS1在乳腺癌耐药细胞系中的水平,结果显示,与亲本细胞相比,耐药细胞系中的AFAP1-AS1水平显著上调。同时,HER-2阳性乳腺癌组织中AFAP1-AS1水平比HER-2阴性乳腺癌组织也明显升高。
随后作者通过表观遗传修饰实验发现在AFAP1-AS1启动子区域大量富集组氨酸乙酰化(H3K27ac)。此外,曲妥珠单抗处理显著增加了亲代乳腺癌细胞H3k27ac的富集水平。总之,AFAP1-AS1在曲妥珠单抗细胞中呈现上调,主要是因为在AFAP1-AS1启动子区域H3K27ac富集增加(Fig.1)。
Fig.1 LncRNA AFAP1-AS1在曲妥珠单抗细胞中上调并被H3K27ac激活
2.干扰lncRNA AFAP1-AS1可以逆转曲妥珠单抗的耐药性
作者对AFAP1-AS1进行干扰后,通过CCK8实验发现AFAP1-AS1敲低会显著增加曲妥珠单抗对细胞活力的抑制作用。此外,EdU染色和Transwell迁移实验表明了敲低AFAP1-AS1也明显降低了细胞增殖和减少细胞活力。
随后作者进一步考察了AFAP1-AS1过表达对SKBR-3和BT474亲本细胞曲妥珠单抗的耐药性影响。实验表明,提高AFAP1-AS1可以消除曲妥珠单抗处理引起的细胞死亡,此外,AFAP1-AS1过表达可以促进细胞的增殖和迁移能力(Fig.2)。
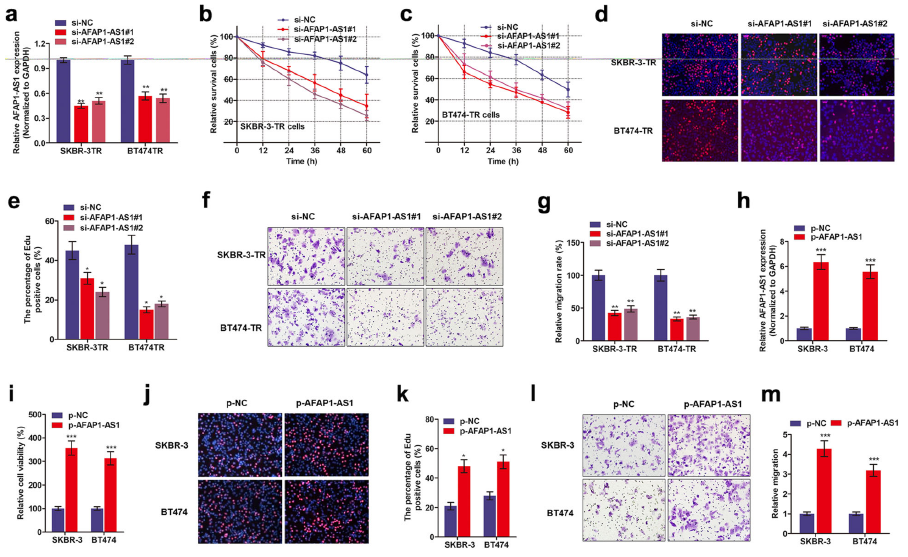 Fig.2AFAP1-AS1敲低能逆转乳腺癌细胞的曲妥珠单抗耐药性
Fig.2AFAP1-AS1敲低能逆转乳腺癌细胞的曲妥珠单抗耐药性
3.LncRNA AFAP1-AS1水平与HER-2阳性乳腺癌患者的曲妥珠单抗耐药性相关
作者用qRT-PCR检测了64个HER-2阳性患者组织样本的AFAP1-AS1表达水平,其中有32例曲妥珠单抗耐药患者和32例曲妥珠单抗反应患者。结果表明,曲妥珠单抗耐药患者中AFAP1-AS1水平比敏感患者显著上调。作者发现,无反应患者血清中的AFAP1-AS1水平比有反应患者的明显提高。此外,Kaplan-Meier分析显示,曲妥珠单抗治疗的乳腺癌患者在接受治疗前,其血清内具有高水平AFAP1-AS1,且与PFS和OS降低相关(Fig.3)。
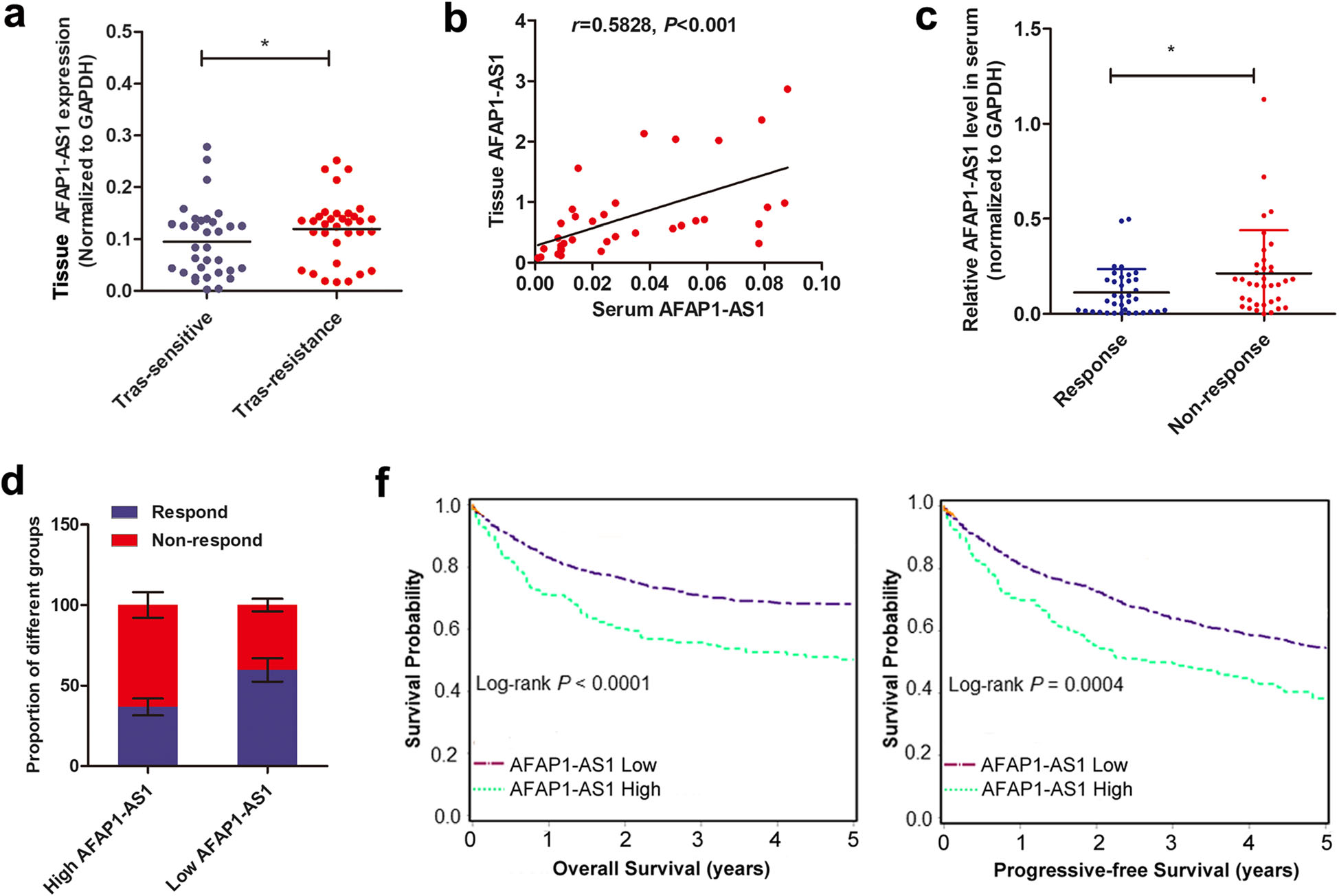 Fig.3高水平AFAP1-AS1与接受曲妥珠单抗治疗的乳腺癌患者的不良反应有关
Fig.3高水平AFAP1-AS1与接受曲妥珠单抗治疗的乳腺癌患者的不良反应有关
4.胞外AFAP1-AS1通过装入外泌体中进行传递
作者用AFAP1-AS1探针进行FISH实验,结果显示,AFAP1-AS1主要分布在曲妥珠单抗耐药细胞的细胞质中,这意味着AFAP1-AS1可能被包裹外泌体中进行分泌。接着,作者用RNAse和Triton×100处理细胞培养上清,发现AFAP1-AS1释放时用膜包裹而不是直接释放。随后,作者分离细胞培养上清中的外泌体,通过TEM、NTA和WB实验进行鉴定,表明分离出的外泌体具有典型的膜状结构、直径大小在30-150nm,且蛋白TSG101和CD81在外泌体中的大量富集。此外,通过对细胞培养上清和外泌体中的AFAP1-AS1进行检测,发现外泌体是胞外AFAP1-AS1分泌的主要载体。同时,作者观察到曲妥珠单抗耐药细胞的培养上清中AFAP1-AS1水平明显比敏感细胞高。
为了了解AFAP1-AS1如何包裹到外泌体中,作者通过RIP实验发现了AFAP1-AS1与HNRNPA2B之间相互作用。再将HNRNPA2B进行干扰或过表达后,AFAP1-AS1水平分别呈现降低或增高。这些结果表明AFAP1-AS1以一种依赖HNRNPA2B1的方式被特异性包裹入外泌体(Fig.4)。
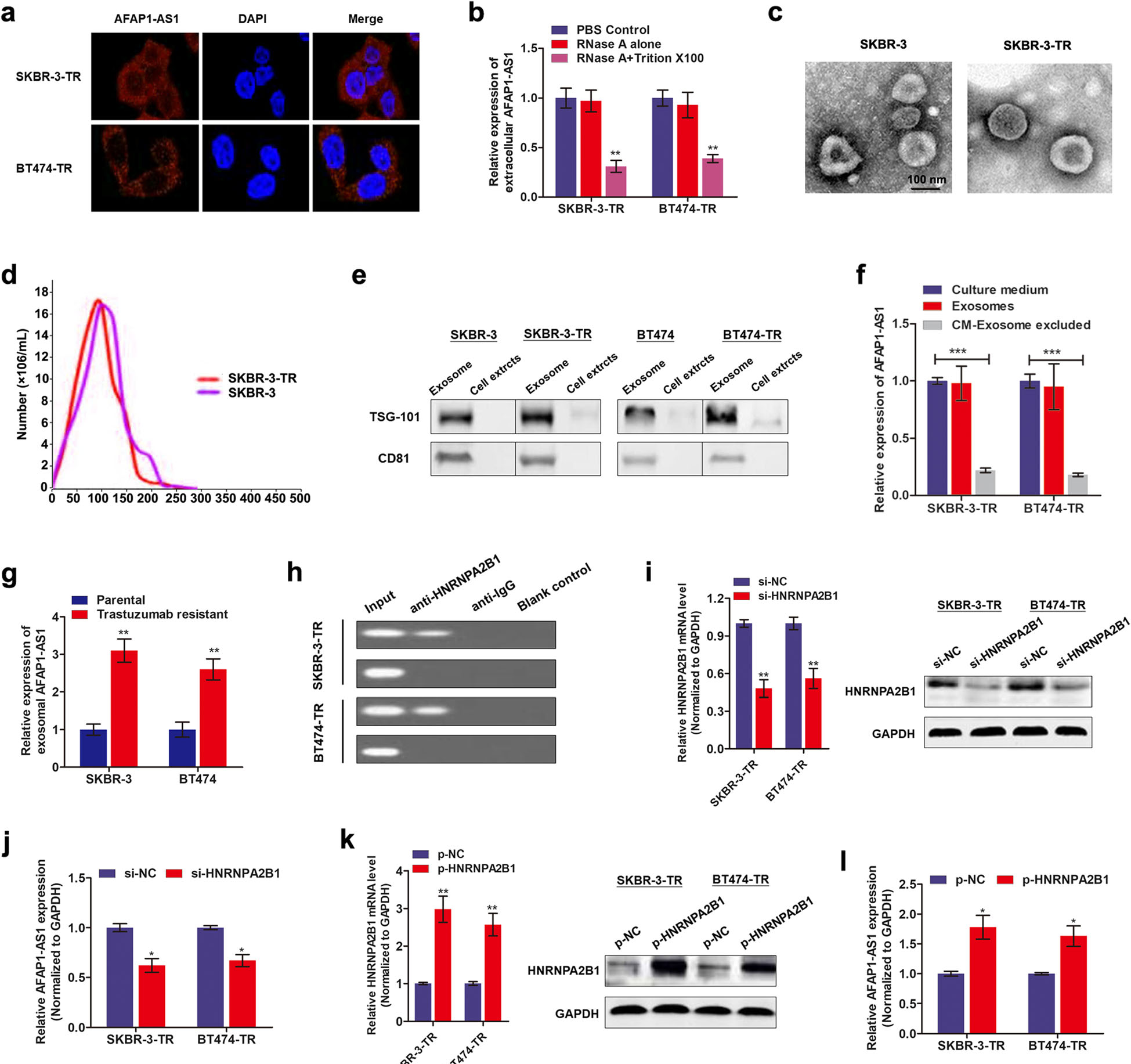 Fig.4 胞外AFAP1-AS1通过包裹入外泌体进行传递
Fig.4 胞外AFAP1-AS1通过包裹入外泌体进行传递
5.外泌体介导的AFAP1-AS1传递可传播曲妥珠单抗耐药
作者从SKBR-3-TR细胞上清中分离外泌体,并用PKH26染料进行标记,再与SKBR-3和BT474共孵育48h,结果显示,受体细胞有强烈的红色信号,表明受体细胞能很好地吞噬外泌体。随后,提取受体细胞质中的RNA用qRT-PCR检测,作者发现与外泌体共孵育后,受体细胞中的AFAP1-AS1水平显著升高,这说明了外泌体中的AFAP1-AS1能够传递到受体细胞中。
作者进一步研究了外泌体递送的AFAP1-AS1是否能同时将耐药表型传递给受体细胞。实验结果显示,用SKBR-3-TR来源的外泌体孵育的亲本细胞对曲妥珠单抗的敏感性降低。再用外泌体分泌抑制剂GW4869处理SKBR-3-TR细胞,用处理后的SKBR-3-TR上清与亲本细胞共孵育,发现上清没有将曲妥珠单抗耐药性传递给受体细胞。同时,敲低AFAP1-AS1和HNRNPA2B1能抑制共培养的亲本细胞获得曲妥珠单抗耐药的能力(Fig.5)。
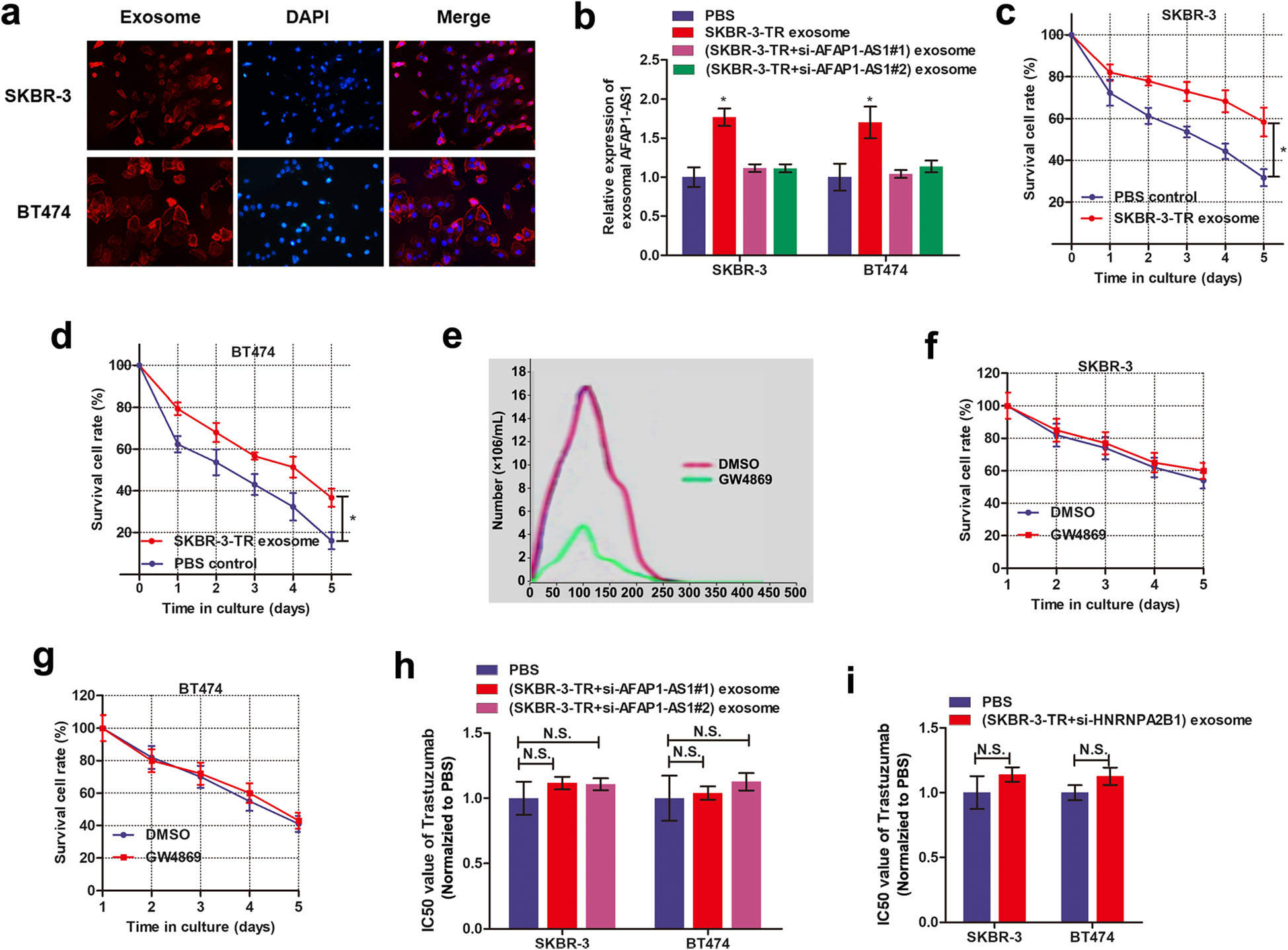 Fig.5外泌体介导的lncRNA AFAP1-AS1转移能诱导曲妥珠单抗耐药性
Fig.5外泌体介导的lncRNA AFAP1-AS1转移能诱导曲妥珠单抗耐药性
6.AFAP1-AS1通过上调HER-2表达诱导曲妥珠单抗耐药性
作者通过免疫荧光检测发现与亲本细胞相比,HER-2蛋白在SKBR-3-TR和BT474-TR细胞中是上调的。在曲妥珠单抗耐药细胞中,敲低AFAP1-AS1能降低HER-2表达,但是用qRT-PCR检测ERBB2(ERBB2用于指示HER-2蛋白的编码RNA)表达时,发现AFAP1-AS1对ERBB2水平影响不显著。此外,过表达AFAP1-AS1能上调HER-2蛋白水平而ERBB2水平不受影响。总之,作者证实了AFAP1-AS1在曲妥珠单抗耐药和HER-2表达上调中的作用,然而,AFAP1-AS1/HER-2信号轴是否参与了曲妥珠单抗耐药还有待进一步证实(Fig.6)。
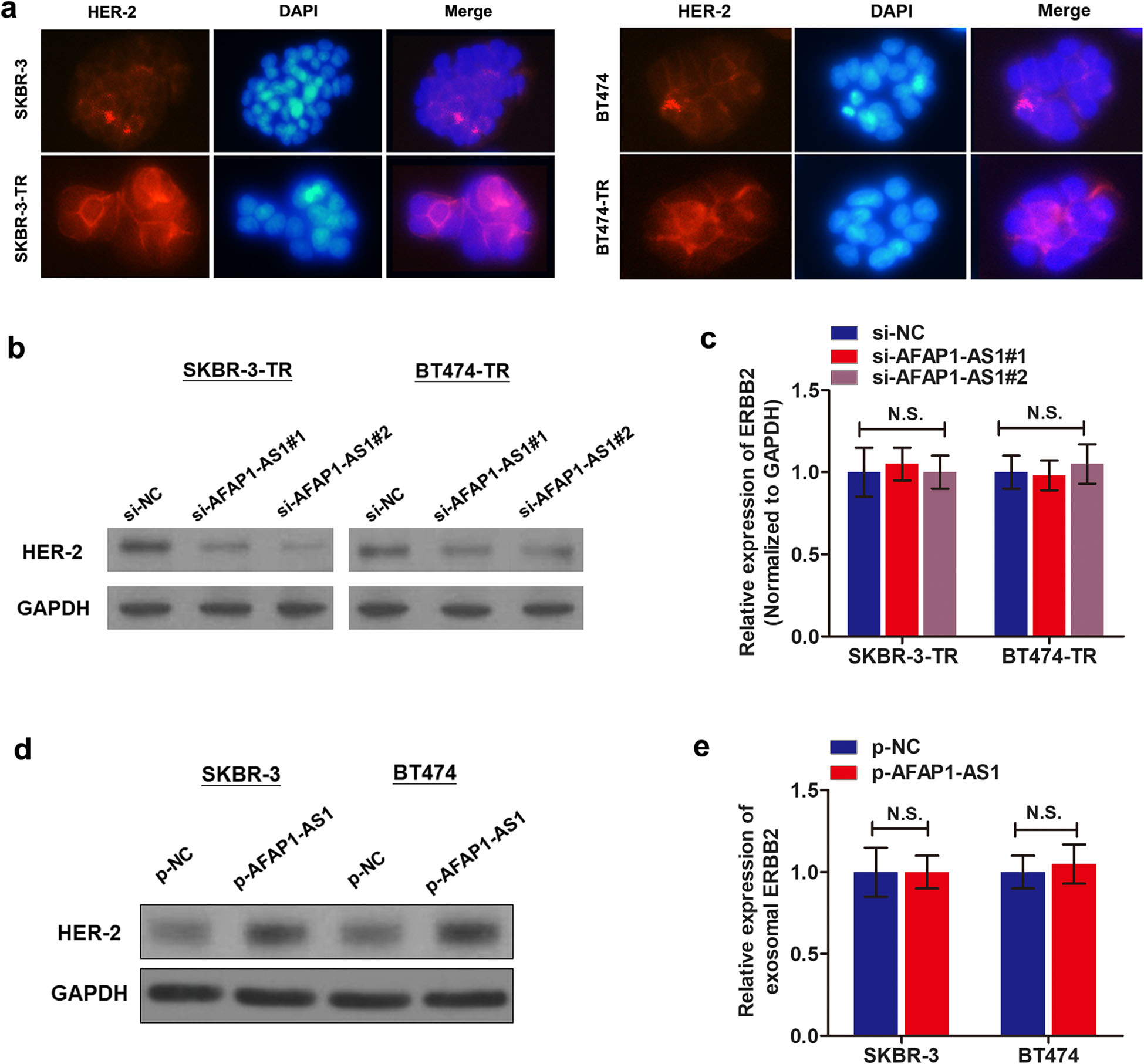 Fig.6 乳腺癌细胞中lncRNA AFAP1-AS1能调节HER-2蛋白水平
Fig.6 乳腺癌细胞中lncRNA AFAP1-AS1能调节HER-2蛋白水平
7.LncRNA AFAP1-AS1与AUF1结合发挥关键作用
作者通过RNA-FISH和细胞分级PCR可以分析出,AFAP1-AS1主要分布在曲妥珠单抗耐药细胞的细胞质中,这揭示了AFAP1-AS1可能在转录后水平调节下游信号通路。作者通过最小自由能(MFE)评估,发现在911-1190nt位点的AFAP1-AS1转录本形成茎环结构,这对于靶向RNA结合蛋白的结合至关重要。随后,通过RNA pulldown实验作者鉴定出了AUF1蛋白,它能够结合到目标mRNA的3’非翻译区(UTR)并促进其翻译而不影响mRNA水平。免疫荧光检测出AUF1和AFAP1-AS1在细胞质中共表达。通过AFAP1-AS1探针设计和RNA pull-down实验,作者发现AUF1蛋白被AFAP1-AS1大量富集。此外,RIP实验验证了AFAP1-AS1可由AUF1沉淀下来。AUF1在转录和蛋白水平上均不受AFAP1-AS1敲低的影响。这些结果表明了AFAP1-AS1能与AUF1蛋白结合,发挥重要的生物功能(Fig.7)。
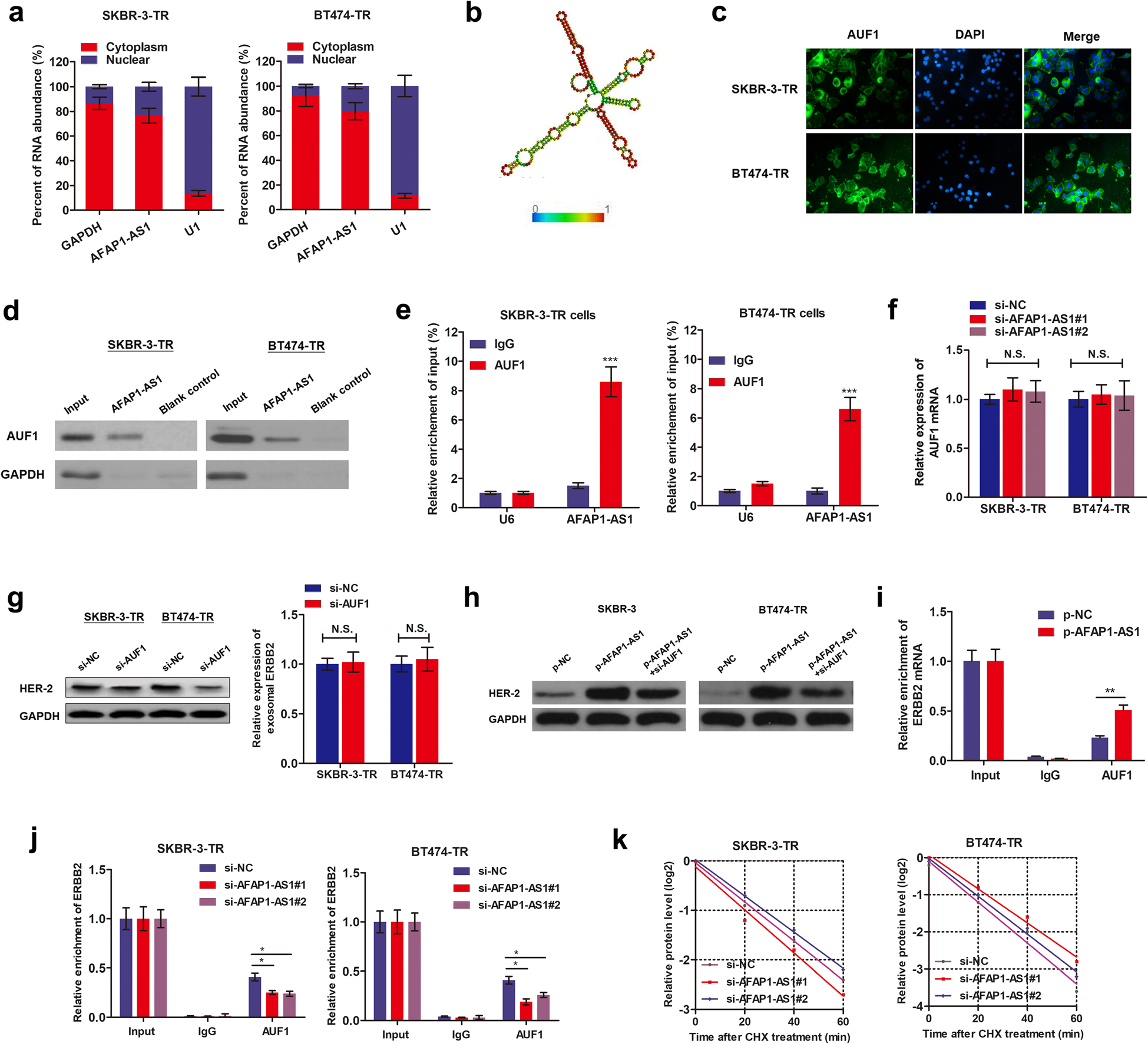 Fig.7AFAP1-AS1与AUF1相互作用,从而激活了ERBB2的翻译
Fig.7AFAP1-AS1与AUF1相互作用,从而激活了ERBB2的翻译
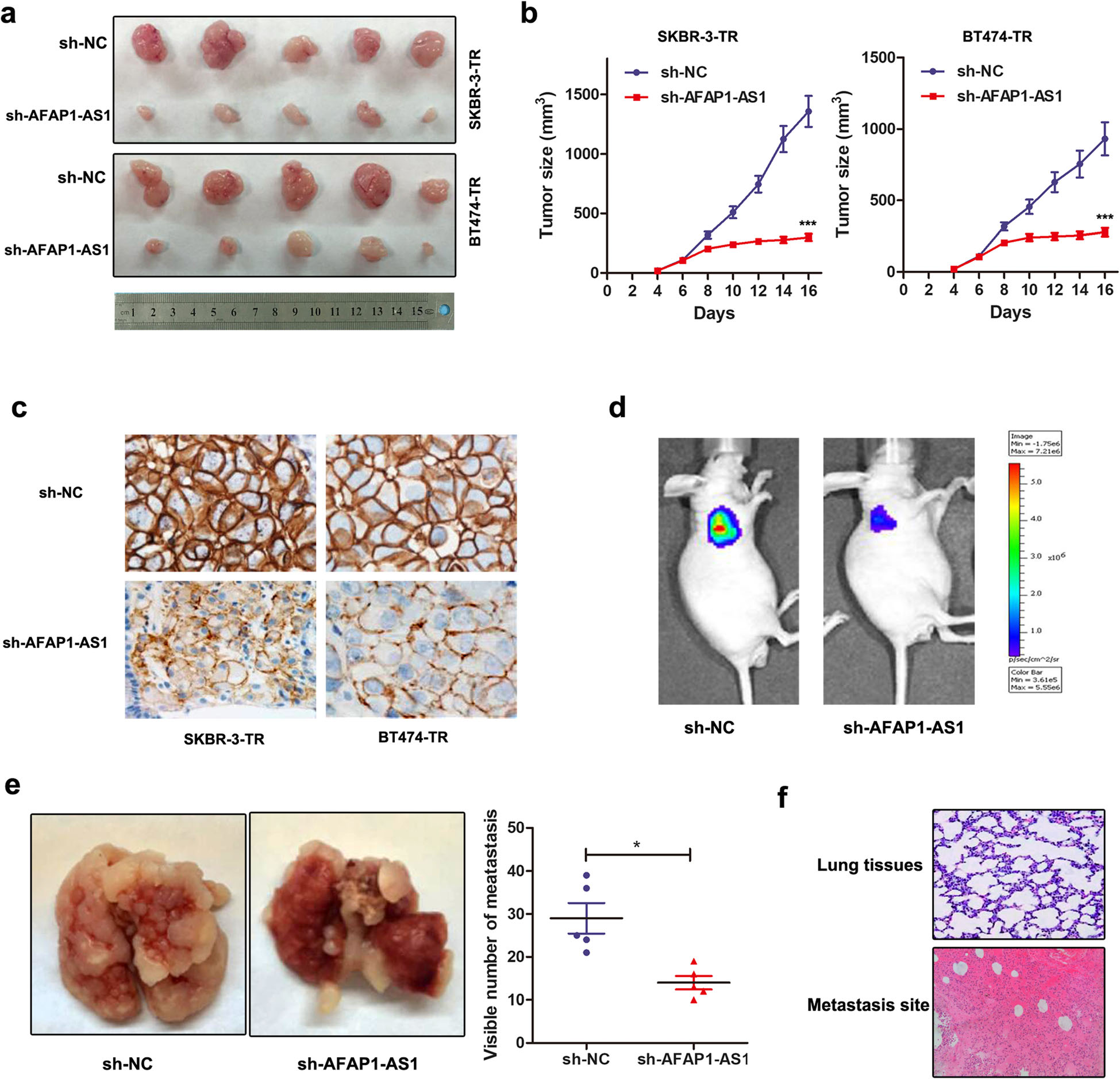
8.敲低AFAP1-AS1可以逆转曲妥珠单抗耐药和体内转移
作者先将SKBR-3-TR和BT474-TR细胞感染了sh-AFAP1-AS1或sh-NC,构建了干扰的稳定株,再将稳定株皮下注射入裸鼠中,形成干扰的动物模型,随后进行曲妥珠单抗腹腔治疗。将20天后裸鼠中的肿瘤剥离并分成不同组,结果显示,sh-AFAP1-AS1组形成的肿瘤明显比对照组小。通过IHC检测发现由sh-AFAP1-AS1感染细胞形成的肿瘤,其HER-2表达水平低于由对照组形成的肿瘤。
作者将感染了sh-AFAP1-AS1的SKBR-3-TR稳定株通过尾静脉注射入裸鼠中,结果发现,由sh-AFAP1-AS1稳定株产生的萤光素酶计量和肺转移灶数明显少于由sh-NC细胞形成的肺转移灶数。与正常肺组织相比,HE染色肺组织转移灶阳性区域明显改善。总之,作者验证了干扰AFAP1-AS1后可逆转妥珠单抗耐药性和乳腺癌的体内转移(Fig.8)
文章结论:
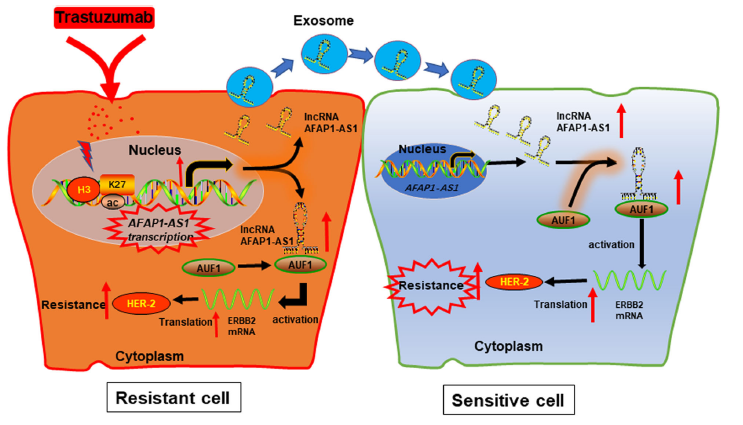
作者从曲妥珠单抗耐药株用lncRNA芯片筛选出高表达的lncRNA AFAP1-AS1,再通过功能获得和缺失实验揭示了敲低AFAP1-AS1能逆转曲妥珠单抗耐药性。此外,细胞外的AFAP1-AS1能与外泌体结合,传递曲妥珠单抗耐药性。机制上,AFAP1-AS1通过与AUF1结合提高ERBB2 mRNA的翻译,从而诱导HER-2蛋白水平的上调,进而引起曲妥珠单抗耐药性(Fig.9)。
Fig.9 曲妥珠单抗耐药传递的机制
和元生物一直致力为外泌体研究提供整体解决方案,从实验设计、外泌体分离、外泌体鉴定、外泌体分子检测到外泌体示踪和体内外功能验证,丰富的项目经验、专业的科研团队、优质的技术支持服务,为您的项目保驾护航!
参考文献:
Mol Cancer. 2020; 19: 26. Exosome-mediated lncRNA AFAP1AS1 promotes trastuzumab resistance through binding with AUF1 and activating ERBB2 translation.