
醉茄素A通过DJ1-Nrf2-STING轴在帕金森病中发挥神经保护作用
引言
醉茄素A(Withaferin A, WA)是从南非醉茄中分离出的一种甾体内酯类成分。醉茄素A被报道具有广泛的抗炎、抗氧化效应,在多种神经系统疾病中均表现出了良好的保护作用。然而,醉茄素A发挥神经保护作用的分子靶点和分子机制仍不明确。在本文中,北京大学郑瑞茂教授团队在不同的帕金森病动物模型中分别验证了醉茄素A对中脑多巴胺神经元的保护作用。使用高通量测序结合生物信息学手段,作者鉴定并验证了DJ1-Nrf2-STING通路作为WA的靶点介导了WA抗帕金森病变的功能。本文阐明了醉茄素A治疗帕金森病的分子机制,提示醉茄素A作为抗帕金森病药物的线索。
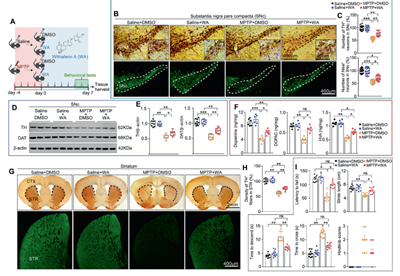
醉茄素A在不同帕金森模型小鼠中起到神经保护作用
为了验证WA在帕金森病中发挥神经保护作用,研究者首先在MPTP诱导的帕金森小鼠模型中分别腹腔给予WA(或对照)处理。通过多种组织学和蛋白质印迹检测,发现相比给予溶剂对照,WA处理可以显著抑制帕金森模型鼠黑质-纹状体通路中多巴胺神经元的丢失。转棒、爬杆等行为学实验的结果表明,WA处理可以显著减轻帕金森模型动物的运动障碍症状(图1)。
本文中除了采用经典的药物诱导帕金森动物模型之外,为了模拟人类帕金森患者从早期到晚期病情逐渐加深这一时间进程,研究者将携带了人类α-突触核蛋白(human α- synuclein,h-αsyn)的腺相关病毒(adeno-associated virus,AAVs)AAV2/9-hsyn-αsyn-GFP注射在小鼠的一侧黑质(图2A)。组织学结果表明病毒注射后21天即可观察到α-突触核蛋白在黑质的TH阳性(TH是酪氨酸羟化酶,是多巴胺神经元的分子标志物)神经元中表达。α-突触核蛋白的过表达导致了黑质区多巴胺能神经元的丢失,并对动物的运动功能造成了损害。蛋白质印迹实验显示,WA处理后小鼠脑组织中不溶性α-Syn和磷酸化的α-Syn(p-α-syn)含量相比溶剂对照处理均表现出下降趋势。WA处理同时降低了黑质多巴胺神经元的丢失,并减轻了动物的运动损伤症状。
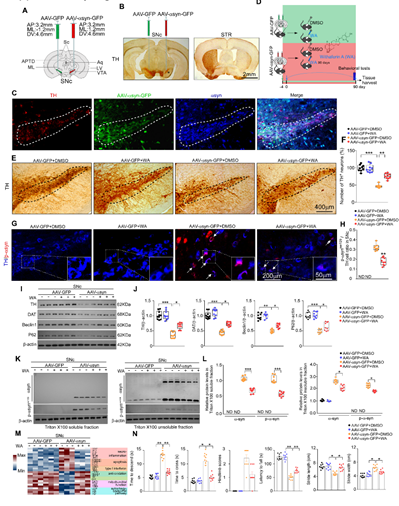
图2 醉茄素A在过表达α-突触核蛋白小鼠模型中起到抗多巴胺神经元丢失的作用
在不同帕金森动物模型中的测试表明,醉茄素A处理可以显著保护黑质的多巴胺能神经元,有效地缓解帕金森模型动物的运动能力损伤。这提示醉茄素A作为候选帕金森治疗药物的潜力。
DJ1-NADJ1-Nrf2-STING轴是WA的作用靶点
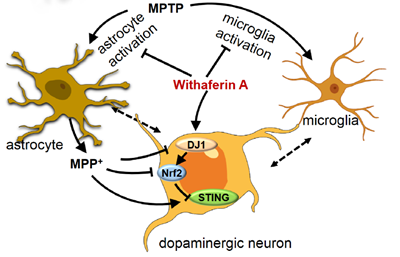
为了破解WA发挥神经保护作用的分子机制。研究者采用全转录组测序的手段检测了WA处理的帕金森小鼠黑质区各相关基因表达变化。测序结果提示,WA上调了多种与多巴胺合成、线粒体功能相关基因的表达,并稳定了MPTP导致的氧化应激、神经炎症相关基因的改变。进一步分析表明,与干扰素刺激因子(stimulator of interferon genes,STING)相关的基因在MPTP诱导的模型小鼠的黑质中发生了高水平的改变,而WA处理则可以部分恢复这些基因表达的变化。这提示STING可能作为WA作用的重要分子靶点。STING是免疫相关的因子,可以被外源性的DNA或内源的线粒体DNA激活而导致免疫反应产生。生物信息学分析提示,帕金森相关基因DJ1和抗氧化因子Nrf2k可能与STING存在互作(图3G)。而针对帕金森患者黑质组织测序结果的荟萃分析(meta-analysis)也表明这三个因子在帕金森病中发生了改变(图3J)。因此以上结果提示STING相关通路可能参与了帕金森病的病理过程,而DJ1、Nrf2、STING则可能是WA发挥神经保护作用中的重要靶点。
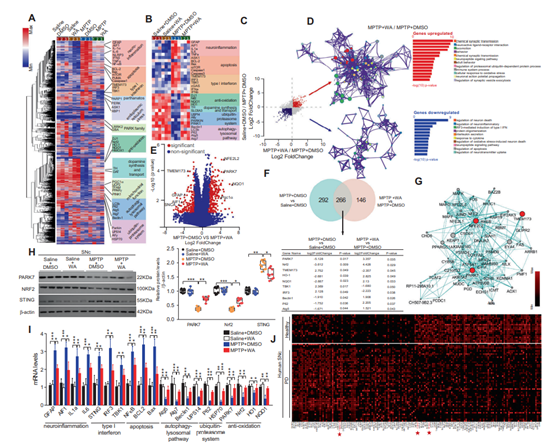
图3 使用醉茄素A处理后的MPTP诱导帕金森模型小鼠黑质中的基因表达分析
为了验证DJ1-Nrf2-STING轴在WA介导帕金森病的神经保护作用发挥作用,研究者分别在帕金森模型小鼠和体外培养的人类多巴胺神经元细胞系(SH-SY5Y)中进行了测试。使用多种转基因小鼠及相关测试,研究者证明STING作为一种新发现的DJ1-Nrf2的下游因子介导了一系列WA处理引发的抗神经炎症反应,验证了该通路作为WA的作用靶点,并提示STING作为抗帕金森的药物新靶点的可能。
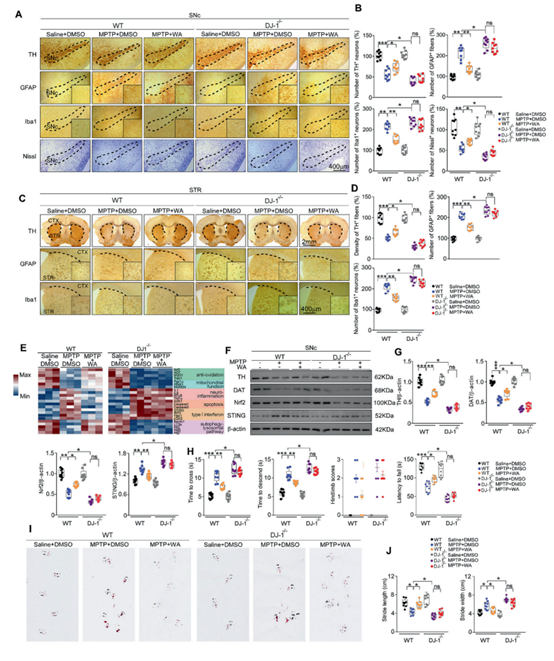
图4 醉茄素发挥神经保护作用依赖于DJ1
结论
原文链接:
https://www.nature.com/articles/s41418-021-00767-2

扫一扫,反馈当前页面
和元生物