
Nat Commun | 上科大管吉松组发现海马体对记忆存储的重要索引机制

“这不仅仅是海马和皮层在认知功能认识上新的突破,而且会对相关的疾病和脑机接口研究有重要的指导意义。”本文第一作者罗文翰介绍,本研究首次提出一种新的认知机制:海马通过内嗅皮层诱导广泛皮层伽马同步来支持记忆写入和提取。
临床意义上来说,阿尔兹海默症萎缩脑区首先就是从海马-内嗅皮层开始的,并且展现出空间感知和记忆能力的下降。因此该研究也可指导新型电刺激疗法的开发:后续刺激疗法可以关注人类的内嗅皮层及附近区域,尝试伽马频段的深部脑刺激,有望为阿尔兹海默症病人的治疗带来曙光。
同时,本研究也证明了独特的伽马波段的脑电同步和认知高度相关,多脑区的伽马频段同步数据不仅包含多脑区相关性信息,也大大丰富了脑机接口的输入数据(BMI, Brain mechine interface),因此也会有利于人类脑电信号的解读(decoding)和相关脑机接口的新设计。
结果
在记忆过程中小鼠的脑电波同步
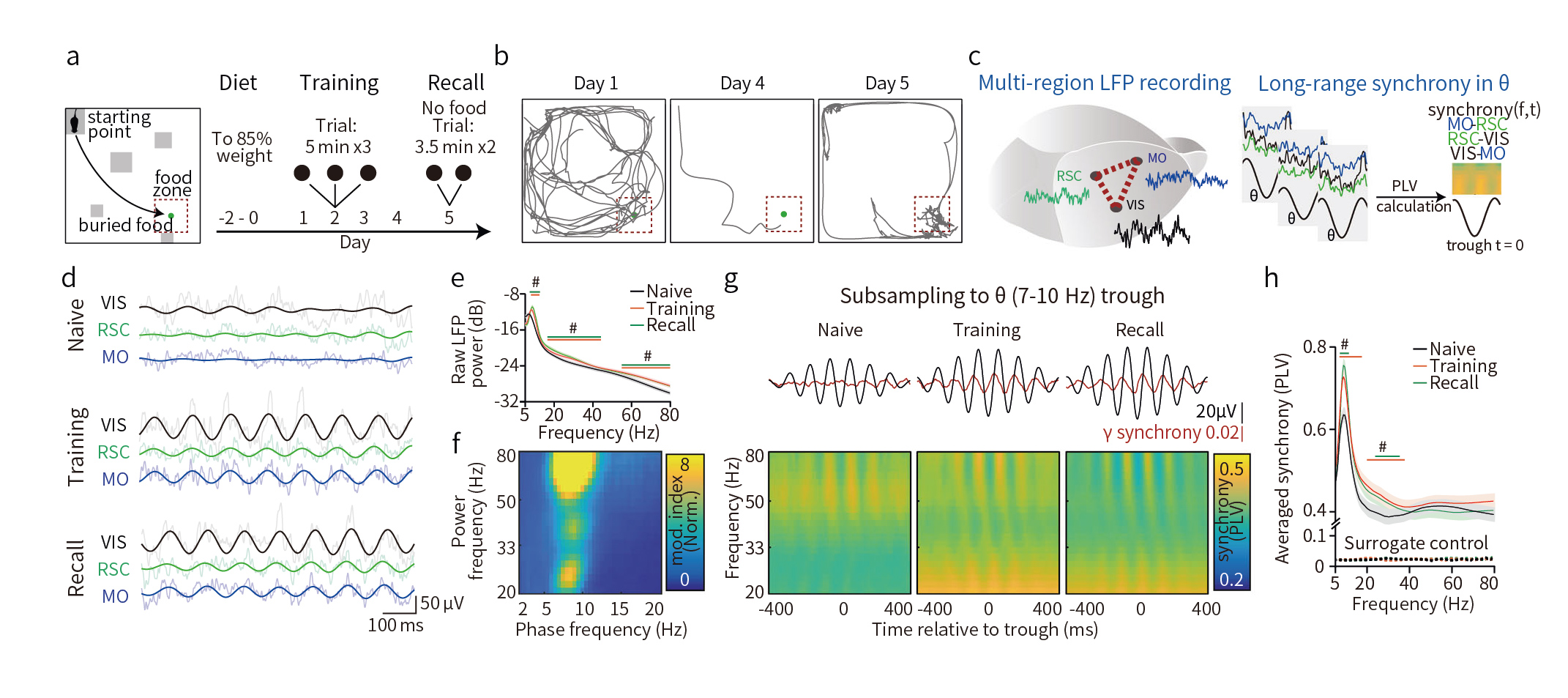
海马和外侧内嗅皮层诱导脑电波同步
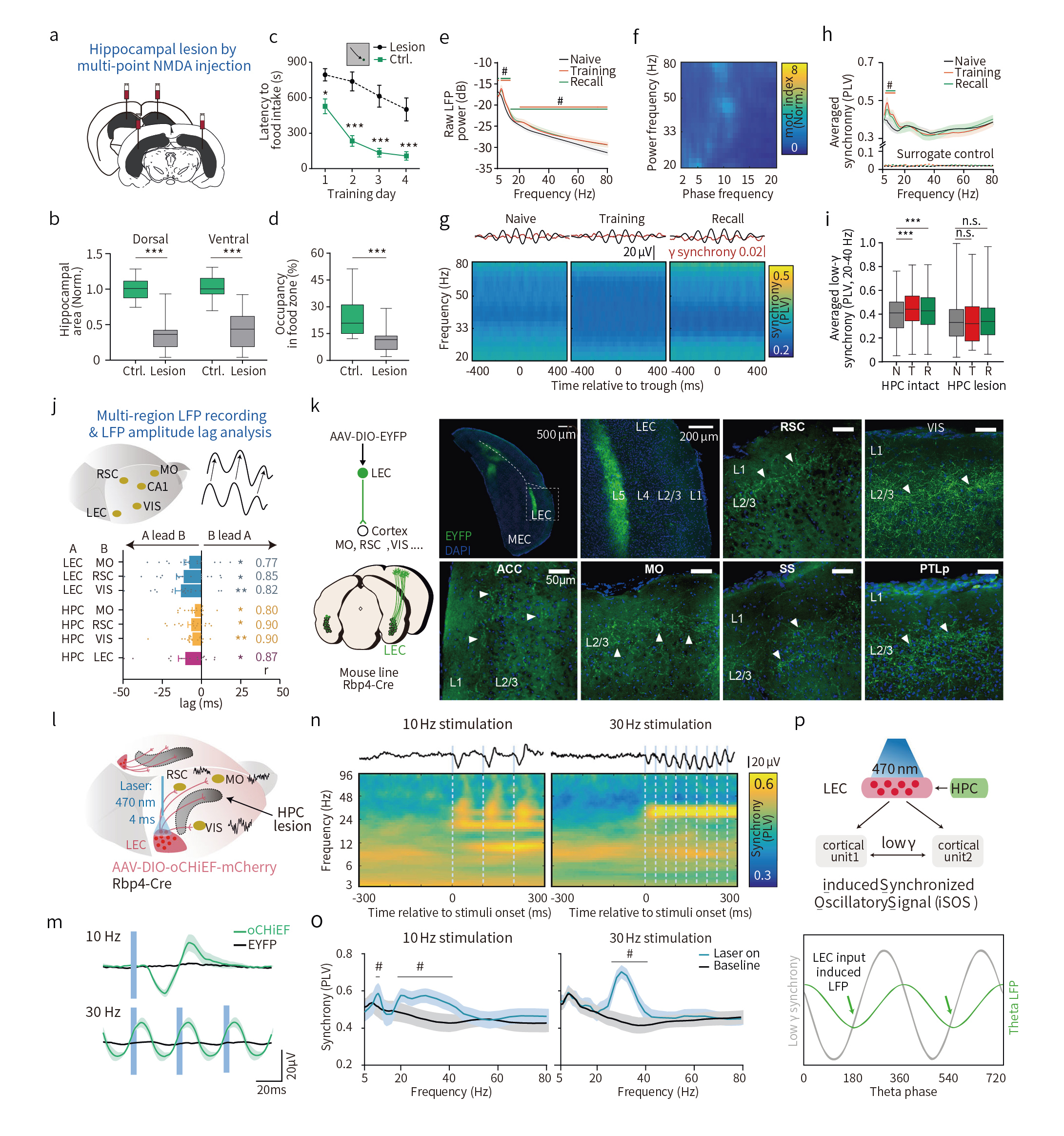
图2 在海马损伤小鼠中,海马依赖的远程皮层gamma相位同步由L5 LEC调控并以iSOS机制重建
人为诱导皮层同步帮助海马损伤小鼠形成新记忆
为探究LEC介导的新皮层gamma相位同步对海马介导的情境性恐惧记忆的重要作用,研究人员通过小鼠颅窗给予470nm LED光照刺激同时激活LEC到皮层各目标脑区(人为诱导iSOS)。结果发现,这些数据表明,iSOS治疗恢复了海马损伤小鼠长期情境性恐惧记忆的编码和存储(图3a-d)。
此外,在空间记忆任务中,iSOS治疗能够帮助海马损伤小鼠形成并检索隐藏食物的空间信息(图3f-g)。这些行为学结果提示了,iSOS治疗和LEC轴突介导的远程gamma相位同步能够协调在小鼠新皮层中存储情境性记忆和空间记忆信息,从而成功地完成记忆提取。
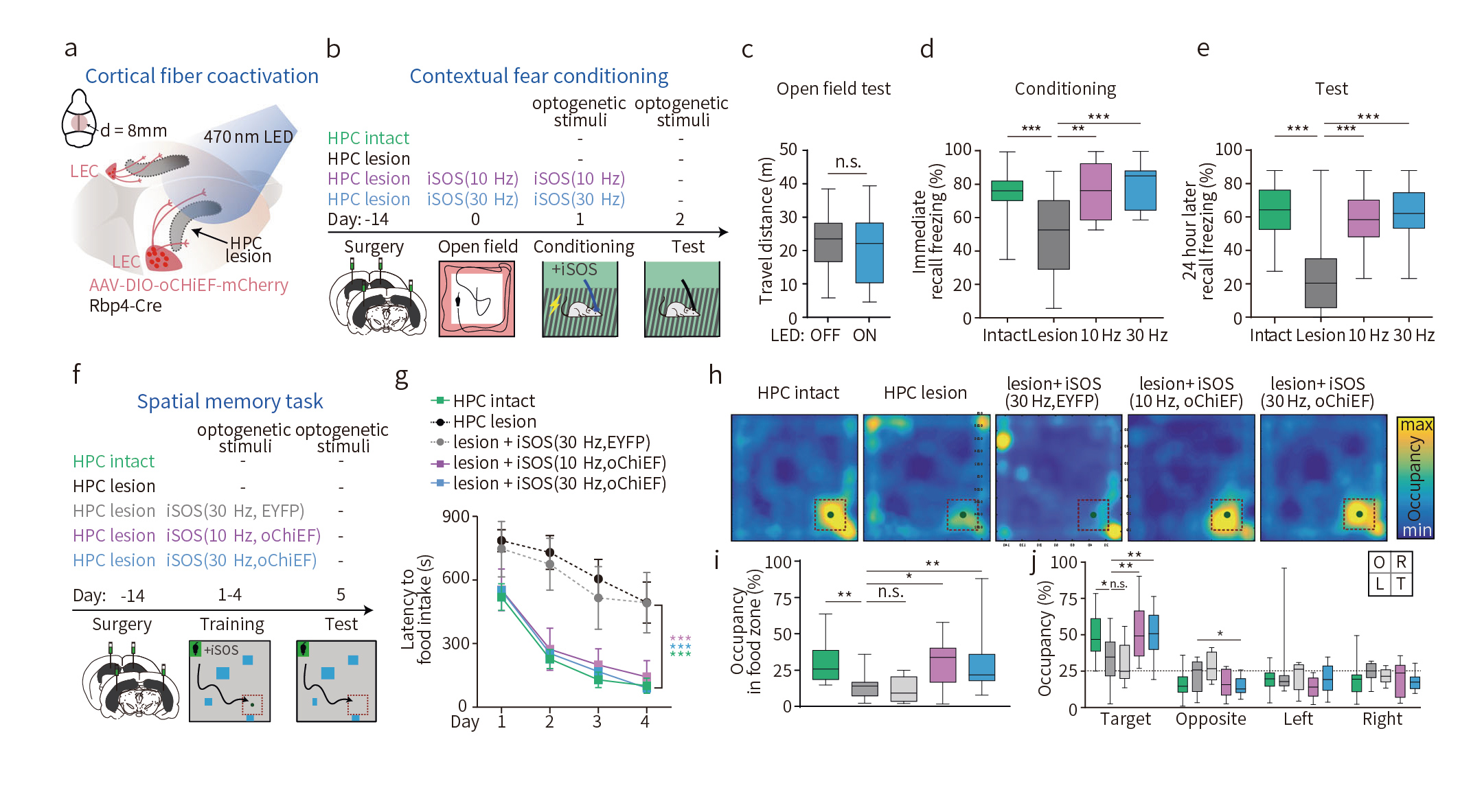
图3 iSOS治疗可以改善海马损伤小鼠的记忆缺陷
随后,作者探究了是大脑皮层脑电波同步,还是LEC轴突末端的激活,参与了海马依赖的皮层记忆储存。研究人员对两组海马损伤小鼠进行连续训练,要么给予iSOS治疗,要么借助光遗传学技术非同步地激活LEC-MO和LEC-VIS的轴突末端(图4a)。结果显示与非同步激活LEC轴突末端处理相比,经iSOS治疗的海马损伤小鼠表现出更优的学习能力和记忆能力(图4b-f)。提示了远程皮层脑电波同步才是空间记忆存储的关键。
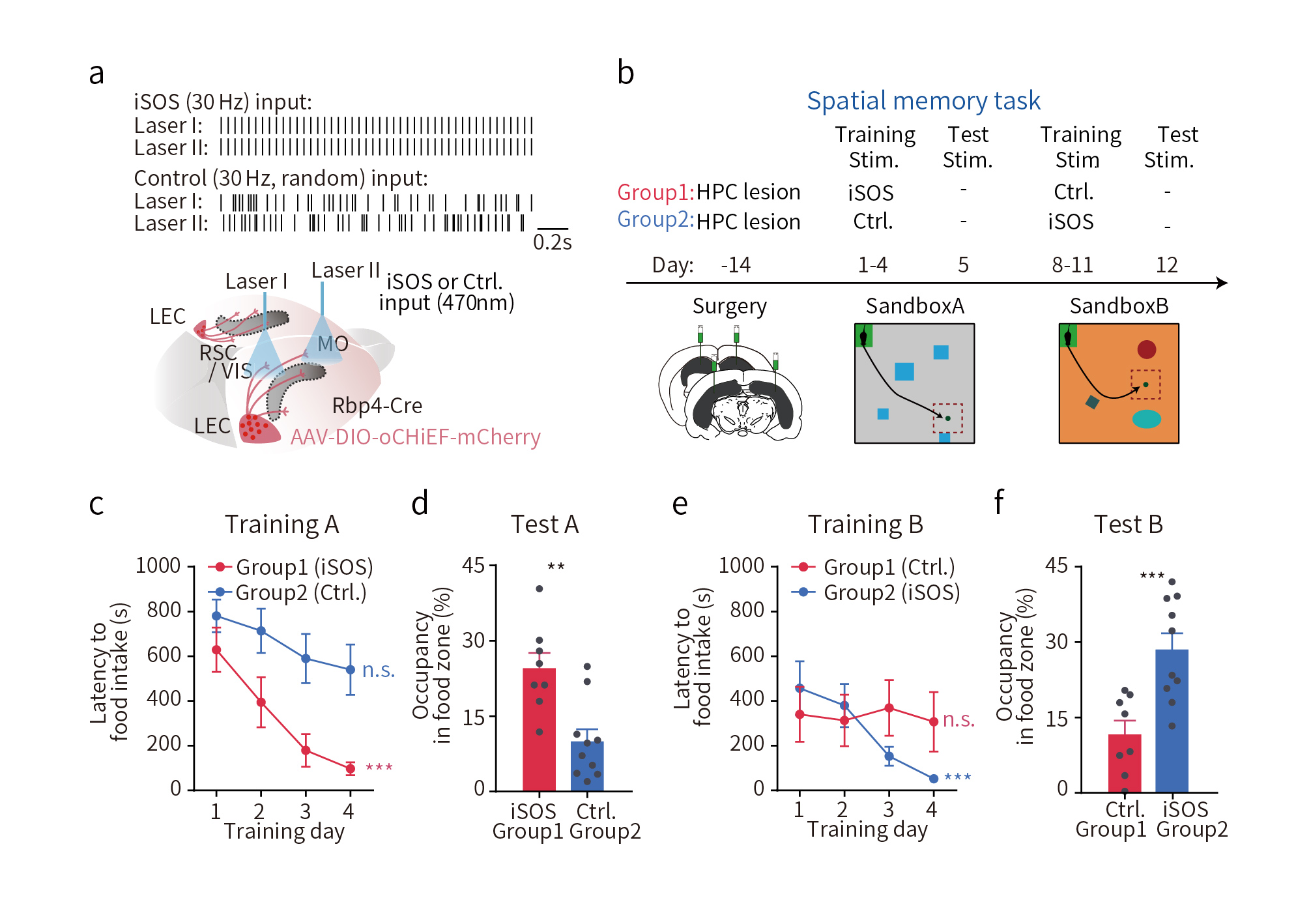
图4 iSOS治疗改善海马损伤小鼠的空间记忆缺陷
记忆细胞的活动与脑电波同步具有高度的相关性
接下来,作者还研究了记忆细胞的活动与脑电波同步的相关性。研究人员在空间记忆任务中设置了预探索阶段(pre-exploring),结果显示,该研究还发现记忆细胞的活动与脑电波同步具有高度的相关性,暗示同步可同时激活多脑区的记忆细胞从而帮助大脑唤起整个记忆网络。有意思的是,研究还发现这些记忆细胞编码小鼠自我为中心的空间信息,例如某个神经元群总是在某个物体位于小鼠身体的左侧时发放(图5)。
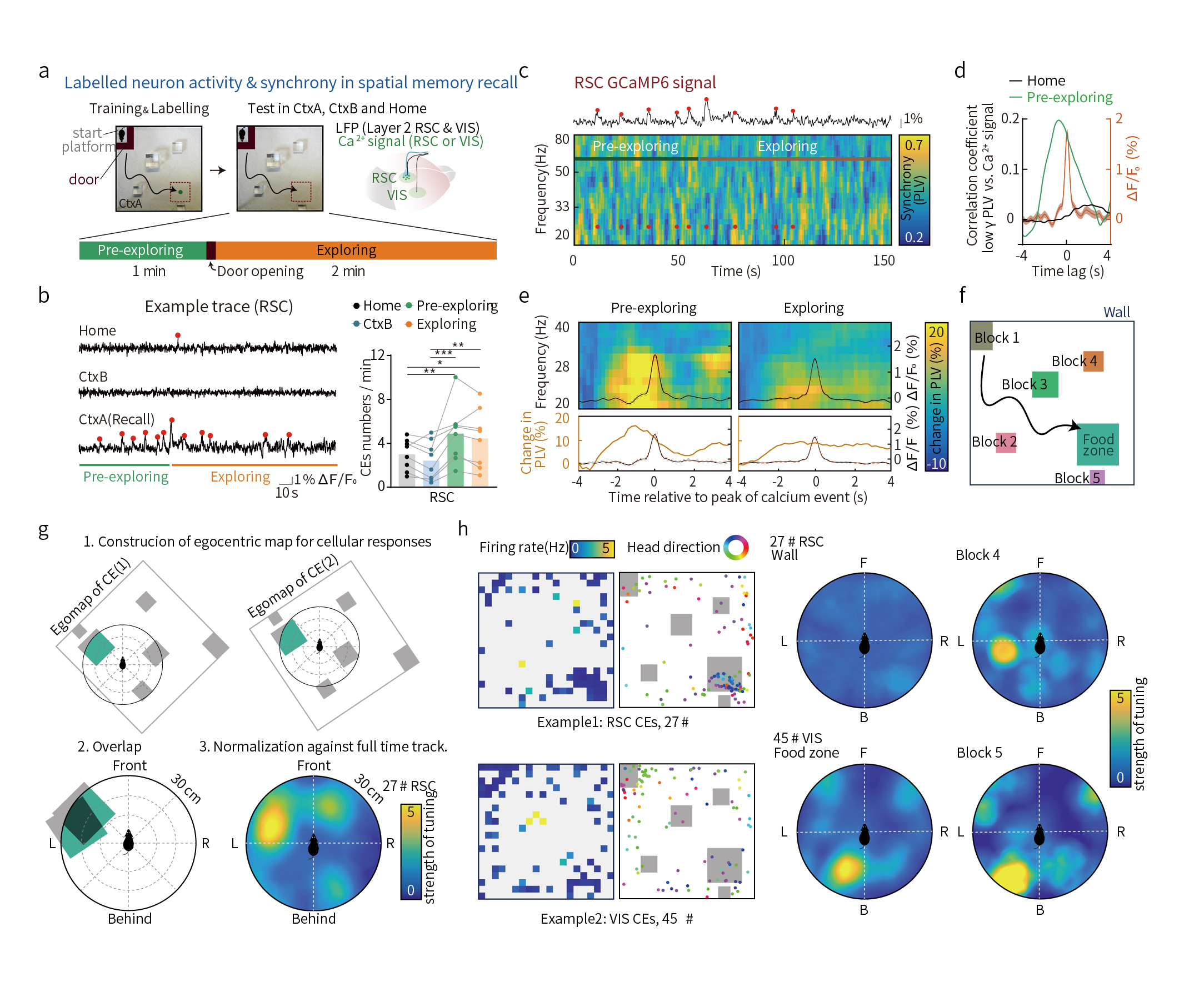
图5 大脑皮层记忆细胞的活动与脑电波同步高度相关性,并在记忆重提过程中表现出自我为中心的编码
最后,研究人员借助化学遗传技术验证LEC介导记忆重现过程中的必要性。研究人员在c-Fos-CreER小鼠LEC区注射AAV-hSyn-hM4D(Gi)-mCherry,CNO抑制LEC活动,发现小鼠表现出记忆缺陷(图6a-c)。同时,LEC活动受到抑制导致预探索阶段标记记忆印迹神经元的再激活减少,也降低了“记忆提取”测试中在预探索阶段标记的皮层记忆神经元的活动频率,消除了记忆印迹细胞的活动与远程gamma相位同步的相关性(图6d-i),提示了海马-外侧内嗅皮层通过gamma同步帮助皮层记忆形成与提取。记忆编码的每个皮质区域的部分上下文信息通过gamma同步进行整合,从而形成完整的记忆表征。
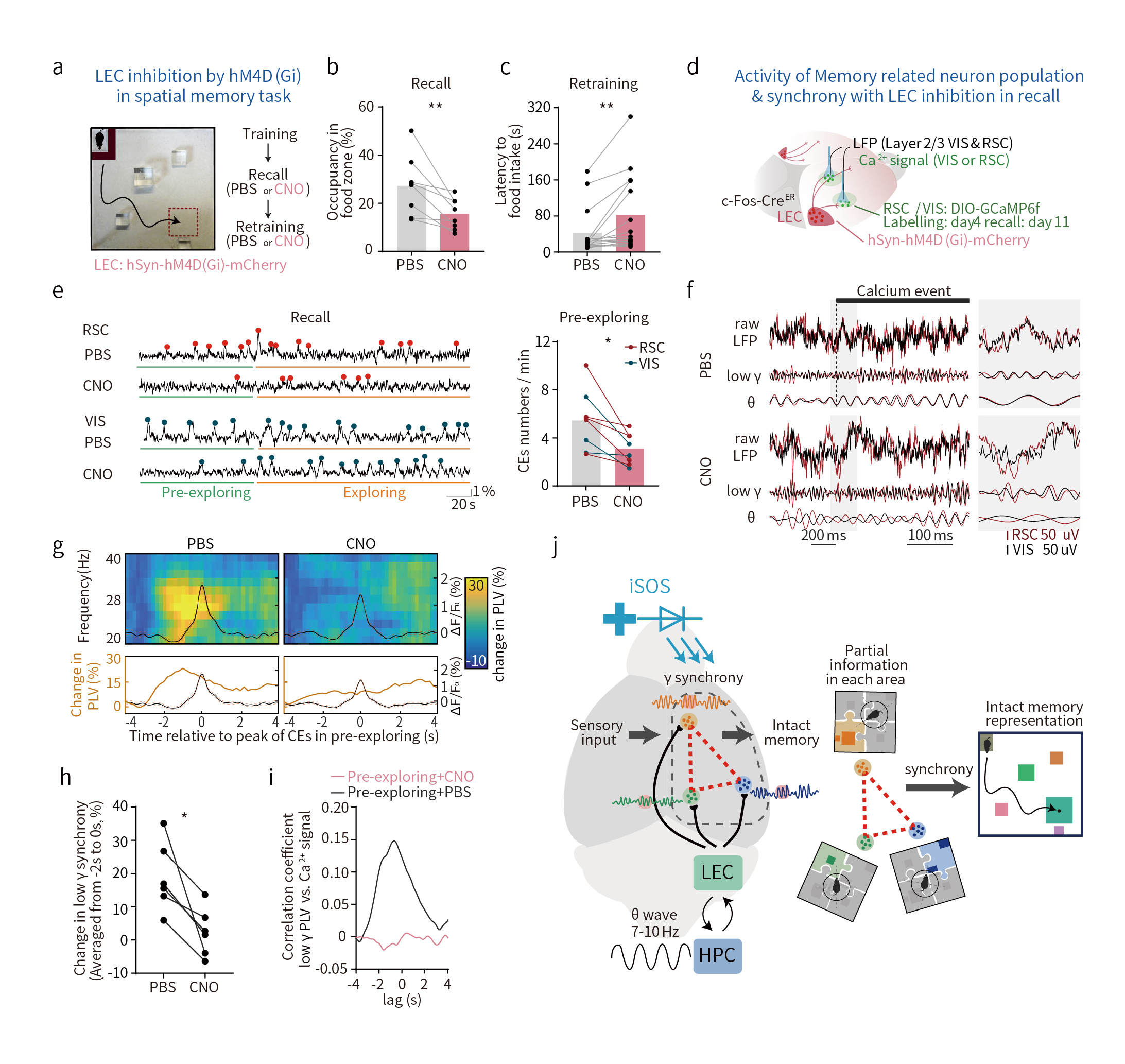
图6 LEC介导的脑电波同步对于大脑皮层记忆细胞的再激活和记忆恢复至关重要
结论
本文借助转基因模型鼠、空间记忆任务等行为学范式、病毒载体示踪技术、光遗传学、化学遗传学等多种技术手段,研究发现,在记忆过程中小鼠不同脑区的脑电波变得同步。后续研究发现了海马体实现记忆写入的重要机制:这种脑电波同步其实是海马和外侧内嗅皮层诱导的,实现皮层各脑区之间的相互通讯,从而促进记忆大脑网络形成。此外,该研究还发现记忆细胞的活动与脑电波同步具有高度的相关性,暗示同步可同时激活多脑区的记忆细胞从而帮助大脑唤起整个记忆网络。最后,研究发现人为诱导皮层同步即可帮助海马破坏的小鼠形成新记忆。
研究挑战了长期以来对海马体短期存储记忆信息的主流猜想,支持了海马提供了记忆索引(indexing)信息,帮助皮层记忆网络进行有效记忆存储与提取的重要机制。该研究印证了人类脑电波研究和多项理论研究推测,即脑电波同步可能对学习记忆有促进作用,由于人体实验的限制性,该推测此前没有确切的实验数据支持和具体的机制,该研究给出十分详细的数据支持脑电波同步在学习记忆中的作用。同时,也为阿尔兹海默症病人(海马体萎缩,记忆力下降)提供治疗的可能性。
上海科技大学生命科学与技术学院管吉松教授为本文的通讯作者,上科大博士后罗文翰、韵迪为本文的共同第一作者。
原文链接:
https://www.nature.com/articles/s41467-022-29208-5#Sec35
未来,我们将以“元载体·GENEDELIVERY”的全新形象为大家提供精准、高效、多元、快速、可靠的病毒载体产品,让和元的“元”载体为你创造无限的可能和未来!
在看不见的地方努力
在看得见的地方收获
别人只追求滴度的时候,我们还追求更有效;
别人只追求纯度的时候,我们还追求更安全;
别人只追求承诺的时候,我们还追求更真实;
别人只追求周期的时候,我们还追求更稳定;
业务咨询


扫一扫,反馈当前页面
和元生物