
J Hazard Mater | 四川农业大学倪学勤团队揭示长期氟暴露所致空间记忆损伤的分子机制
氟化物是一种公认的环境污染物,在全球范围内广泛存在,我国长期存在饮水型、燃煤型及饮茶型等不同类型的高氟暴露现象,是遭受氟威胁最严重、地区分布最广泛的国家之一。虽然适量的氟对机体牙齿、骨骼的钙化、神经兴奋的传导和酶系统的代谢均有促进作用,但大量的研究表明高氟暴露可严重危害机体健康,包括诱发氟中毒,氟骨病等,还会对肾脏、肝脏、心血管、免疫系统、中枢神经系统等组织均有不同程度的损害作用。值得注意的是,氟化物引起的脑损伤导致中枢神经系统受损的报道先于牙齿病变,研究发现,氟化物暴露可损害神经中枢并诱导记忆功能障碍,且脑功能损伤及其潜在机制可能因氟化物剂量而异。然而氟化物诱发脑功能障碍的机制仍不明确。
研究成果
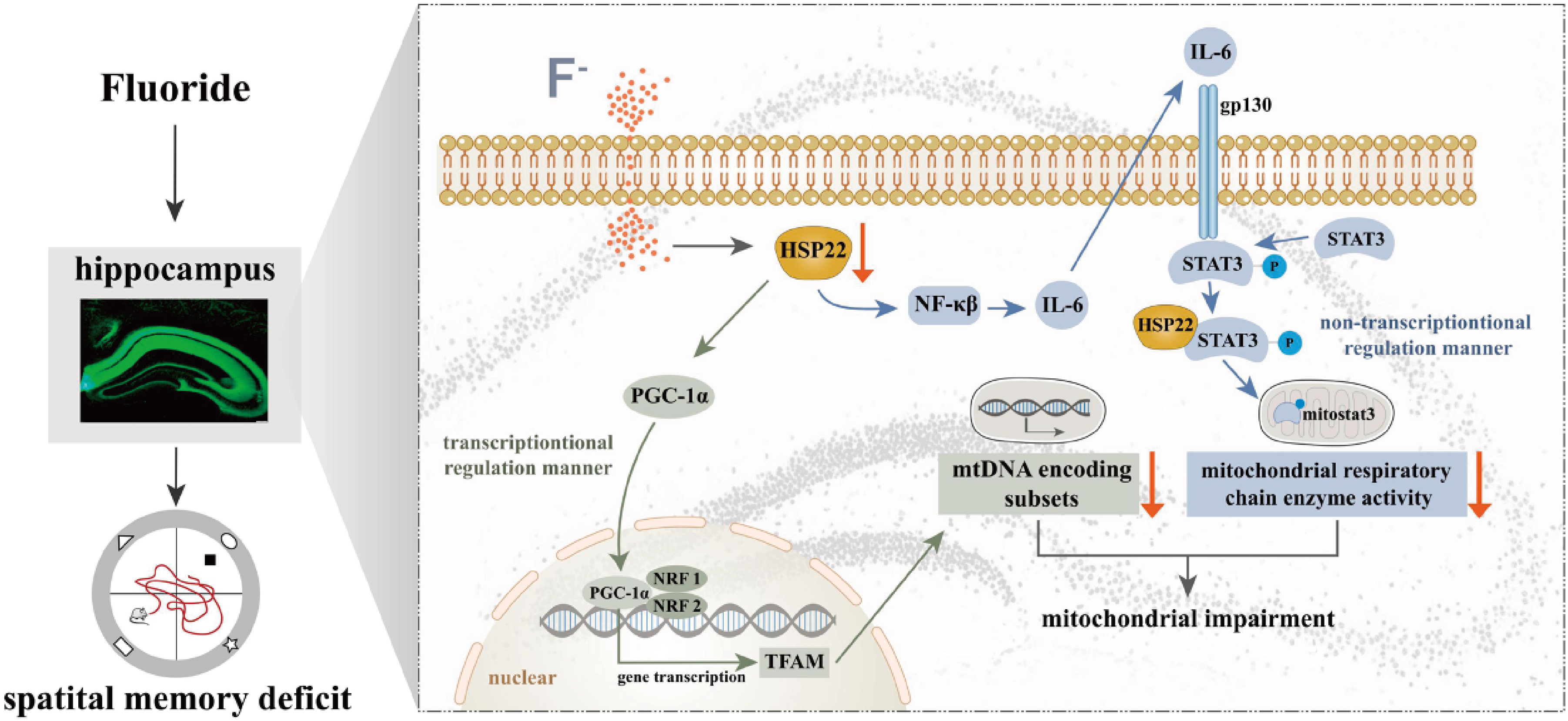
2023年5月7日,四川农业大学动物医学院倪学勤教授团队在国际环境领域知名期刊《Journal of Hazardous Materials》上发表题为“Prolonged Fluoride Exposure Induces Spatial-memory Deficit and Hippocampal Dysfunction by Inhibiting Small Heat Shock Protein 22 in Mice”的研究论文。该研究揭示了长期高氟饮水可导致小鼠线粒体结构和功能受损,调控线粒体结构和功能的蛋白Hsp22通过介导PGC-1α-TFAM和NF-κβ-STAT3这两个关键信号通路参与高氟所致空间记忆损伤的重要潜在机制。该成果进一步提示了长期生活于高氟暴露地区人民的潜在健康隐患。

结果
01 长期接触氟化物导致小鼠空间记忆缺陷及认知功能障碍
首先,研究团队构建氟暴露小鼠模型:4周龄小鼠给予含25ppm(低剂量组)或50ppm(高剂量组)NaF的含氟饮用水,持续56周至老年期(图1A)。借助Morris水迷宫试验(Morris water maze, MWM)探讨了慢性氟化物暴露对认知功能的影响,定位航行实验和空间探索实验结果显示,氟暴露组小鼠的逃避潜伏期显著增加,在有效区域(原平台所在区域)穿梭停留时间明显降低,提示了长期接触氟化物导致小鼠空间记忆缺陷,认知学习能力下降,且损伤程度与氟暴露之间存在剂量依赖关系(图1)。
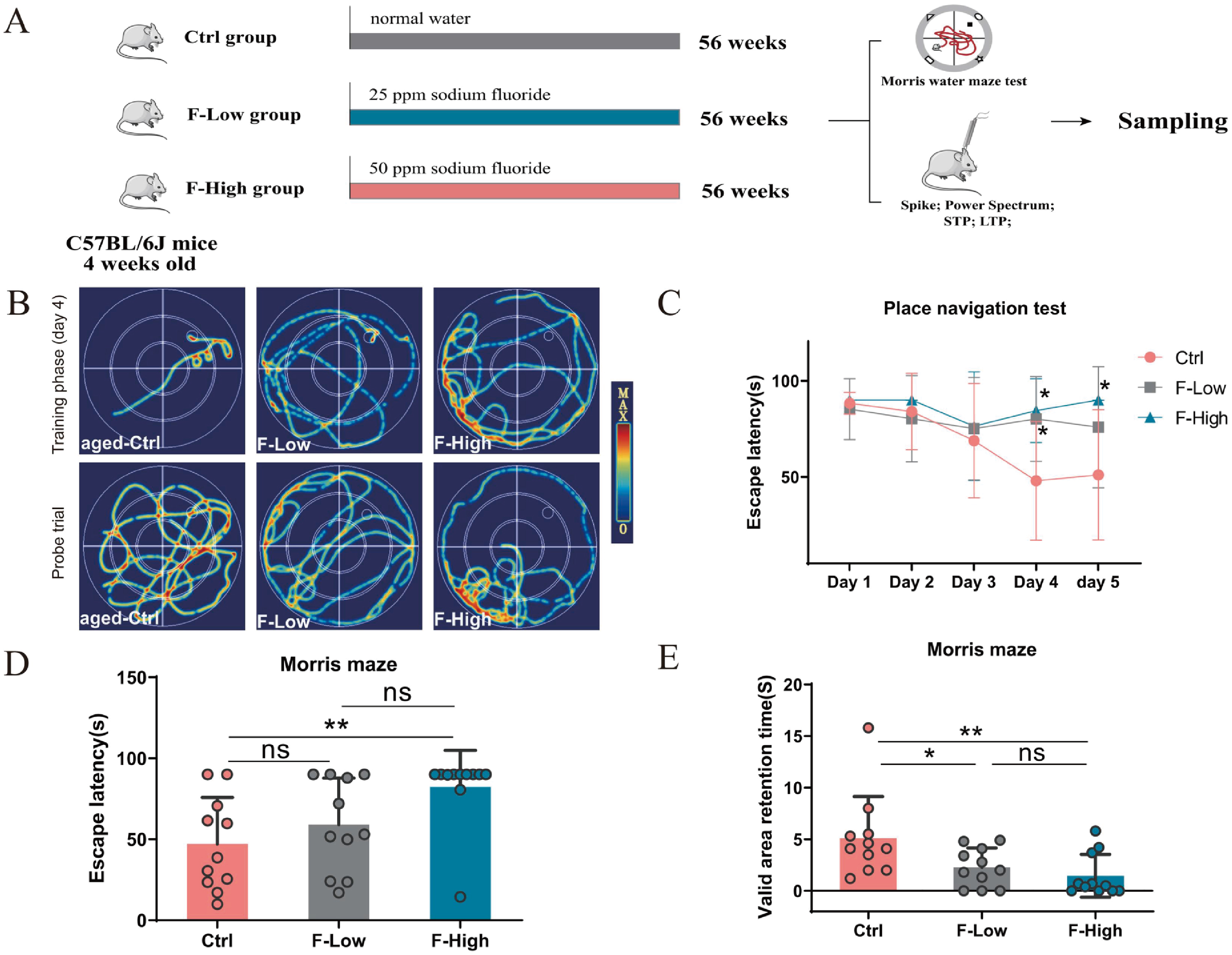
图1 长时间接触氟化物导致小鼠空间记忆障碍
为研究氟暴露是否会在短期内导致小鼠记忆缺陷,研究者分别给予8周龄和48周龄小鼠含氟(50ppm)饮用水,连续12周(图2A,B)。MWM结果显示,短期氟暴露组小鼠穿越原平台次数及逃避潜伏期和对照组小鼠相比无明显区别(图2C,D),神经元功能维持至关重要的功能基因BDNF和CREB蛋白表达水平也无明显变化(图2E,F)。这些结果提示了氟化物暴露在短期内不会引起记忆缺陷,引起高氟所致空间记忆损伤取决于长期暴露。
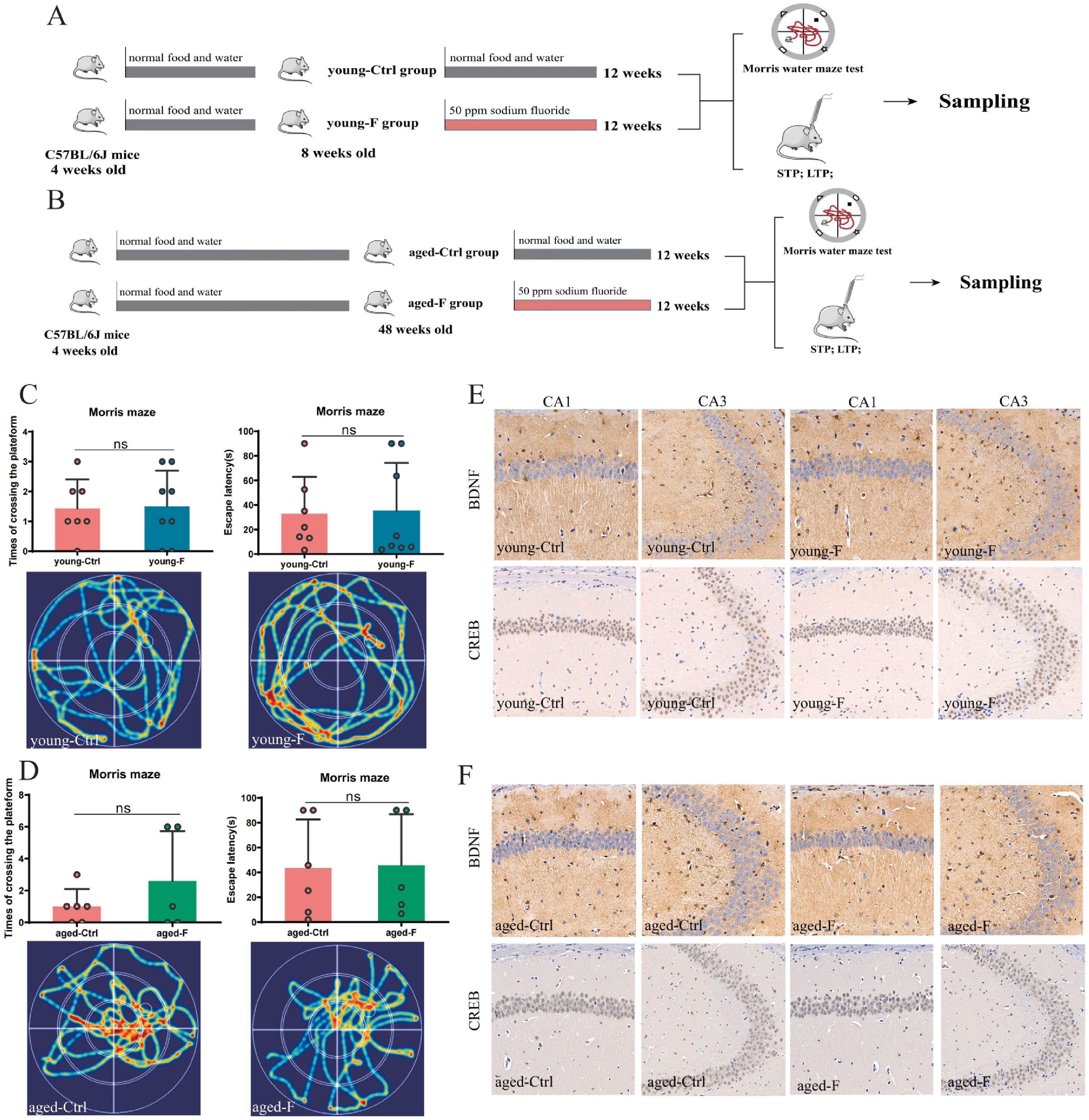
图2 短期氟化物暴露不会引起小鼠记忆缺陷
02 长期氟暴露诱导小鼠海马损伤及线粒体结构和功能障碍
接下来,研究团队探究长时间氟暴露对小鼠海马的影响,发现氟暴露组小鼠的体重、脑重,以及高剂量氟暴露组(F-High)小鼠的脑体指数均明显低于对照组小鼠(图3A),氟暴露引起的病理改变主要在海马CA3和CA1区,表现为神经元变性显著增加,F-High组小鼠神经元数量明显降低(图3D)。氟暴露组小鼠海马中BDNF和CREB的mRNA和蛋白水平显著下降(图3B,C,E)。这些结果提示了长期接触氟化物诱导海马损伤。
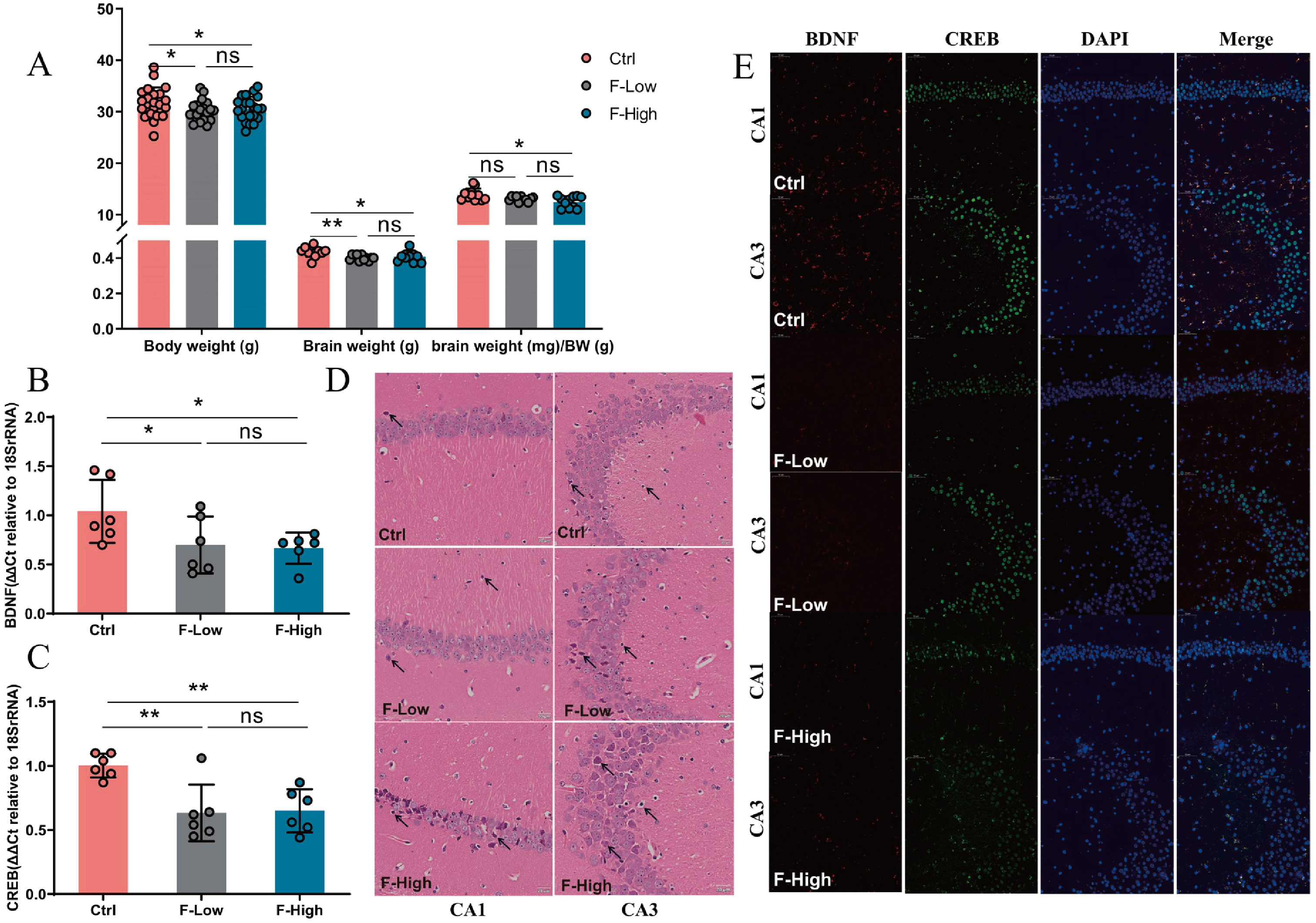
图3 长期氟暴露诱导海马损伤和记忆相关蛋白下调
随后,研究团队进一步探究了氟暴露对海马神经振荡和神经元动作电位发放的影响。通过对小鼠海马CA1神经元进行细胞外记录,发现氟暴露诱发局部场电位(local field potential, LFP)光谱功率变化,LFP显著降低,同时theta, alpha, beta和gamma频段振荡下降(图4B)。此外,氟暴露组小鼠的海马神经元放电明显降低,诱导LTP的能力受损(图4C,D)。以上结果均呈剂量依赖性(图4)。
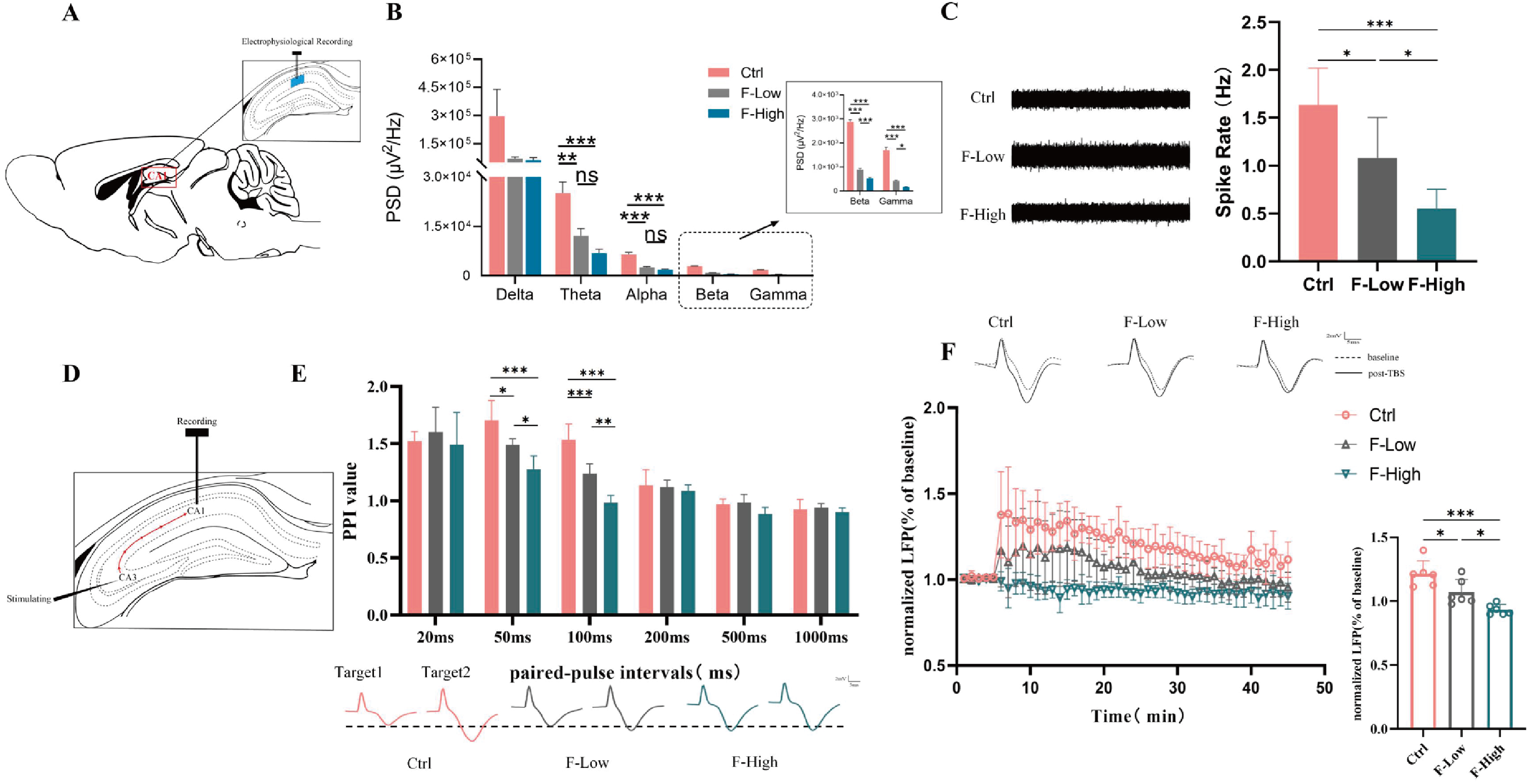
图4 长期氟暴露改变了海马神经元放电
透射电镜(TEM)观察发现,氟暴露组小鼠海马线粒体结构异常,神经元凋亡(图5A),线粒体膜电位(mitochondrial membrane potential,MMP)和ATP含量呈剂量依赖性下降(图5B,C)。通过对海马线粒体呼吸链复合体分析发现,氟暴露导致线粒体生物发生受到抑制,呼吸链复合体I/II/III/V活性明显降低(图5D-G)。
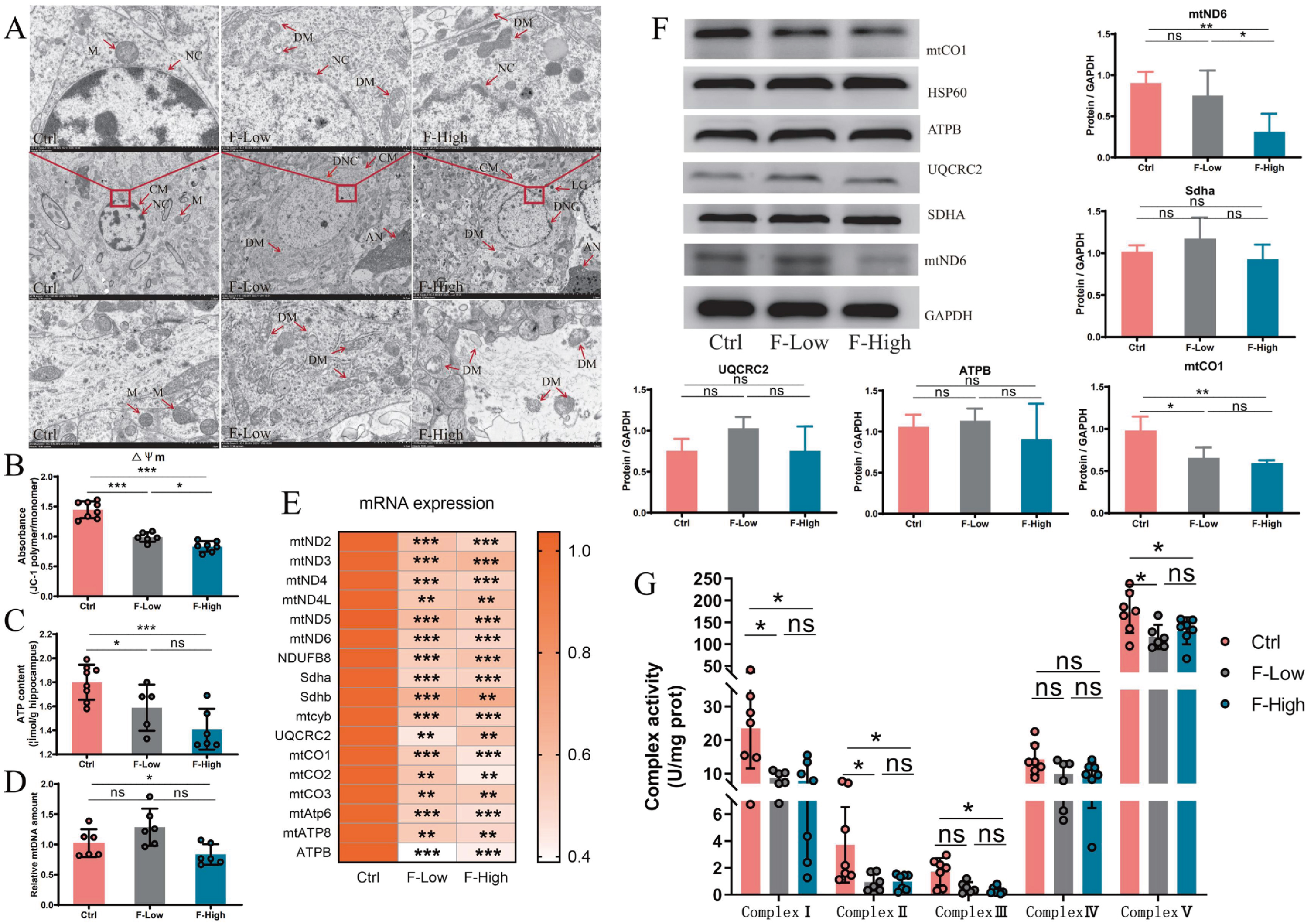
图5 长期氟暴露诱导海马神经元线粒体功能障碍
03 长期氟暴露抑制Hsp22的表达及其介导的PGC-1α/ TFAM和NF-κβ/STAT3信号通路
基于上述结果,研究团队进一步探讨了介导这些影响的潜在调节因子。借助分子生物学技术发现,长时间氟暴露组小鼠中Hsp22和ATF4的表达显著降低(图6A,B)。Hsp22缺失和ATF4高表达抑制了线粒体功能,Hsp22可通过PGC-1α-TFAM和NF-κβ-STAT3这两个关键信号通路介导线粒体功能。PGC-1α-TFAM信号通路促进线粒体生物发生,NF-κβ-STAT3信号通路提高线粒体呼吸链酶的活性。鉴于此,作者研究这两条信号通路发现,氟暴露导致PGC-1α-TFAM和NF-κβ-STAT3信号通路被抑制,PGC-1α蛋白水平降低,高剂量氟暴露组TFAM蛋白水平亦显著降低(图6C-E)。此外,细胞和线粒体中STAT3的蛋白水平各组间无显著差异,线粒体中p-S727 STAT3(被Hsp22激活并易位到线粒体的效应蛋白)表达水平呈氟暴露剂量依赖性降低(图6E,F)。
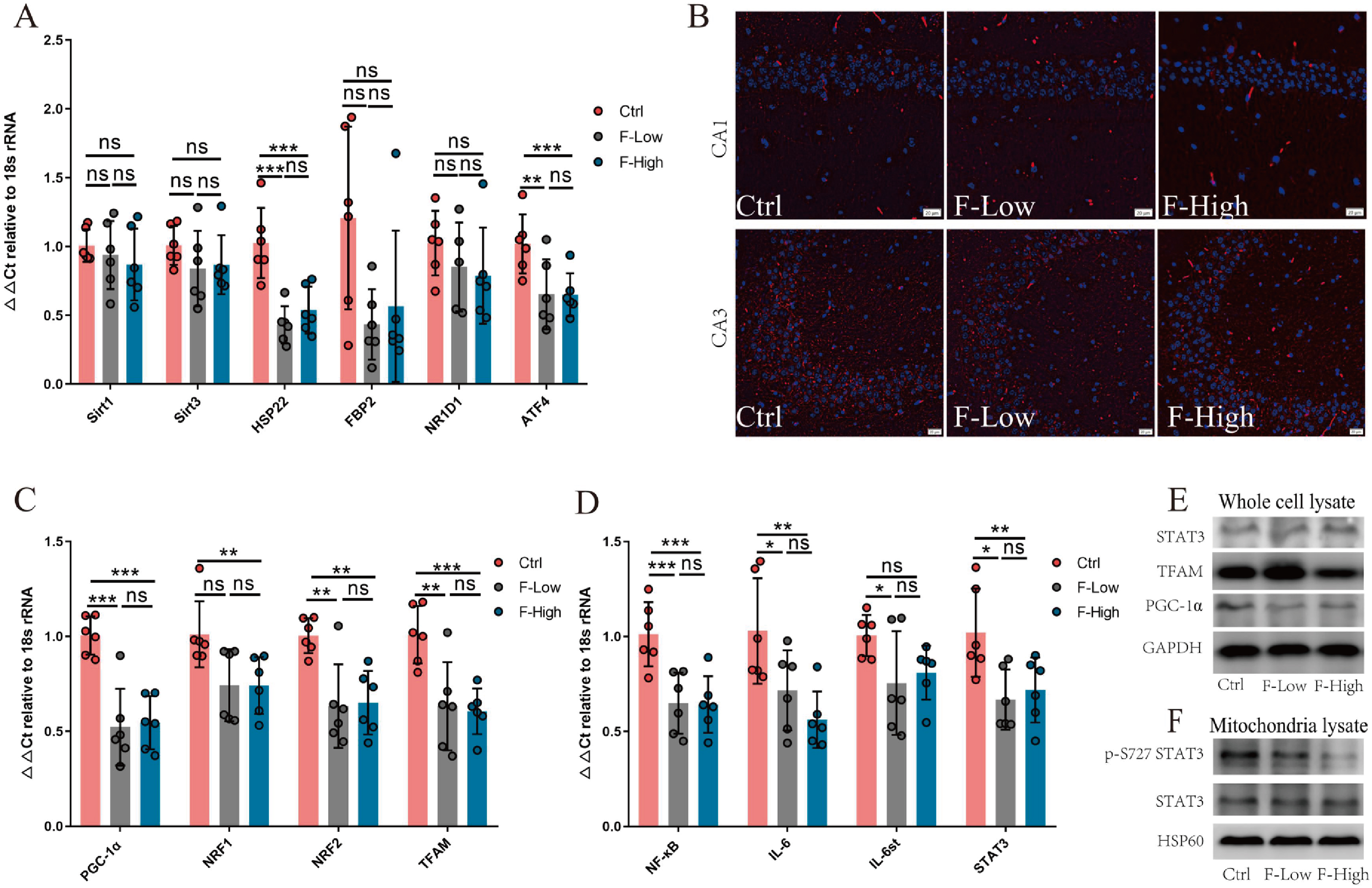
图6 长期氟暴露抑制海马Hsp22的表达及其介导的线粒体调控通路
04 Hsp22通过介导PGC-1α-TFAM和NF-κβ-STAT3信号通路双向调控长期氟暴露诱发的空间记忆缺陷
为探究Hsp22是否参与氟暴露诱导的小鼠记忆缺陷,研究者在小鼠海马区注射pAAV-hSyn-EGFP-P2A-Hspb8–3xFLAG-WPRE病毒,以特异性在海马神经元中过表达Hsp22(图7A-C)。MWM结果显示,过表达Hsp22(F + pAAV-Hsp22)可显著逆转由氟化物暴露引起的逃避潜伏期增加和穿越原平台次数减少的现象(图7D,E)。这提示了Hsp22过表达改善了长时间氟暴露诱发的空间记忆缺陷。
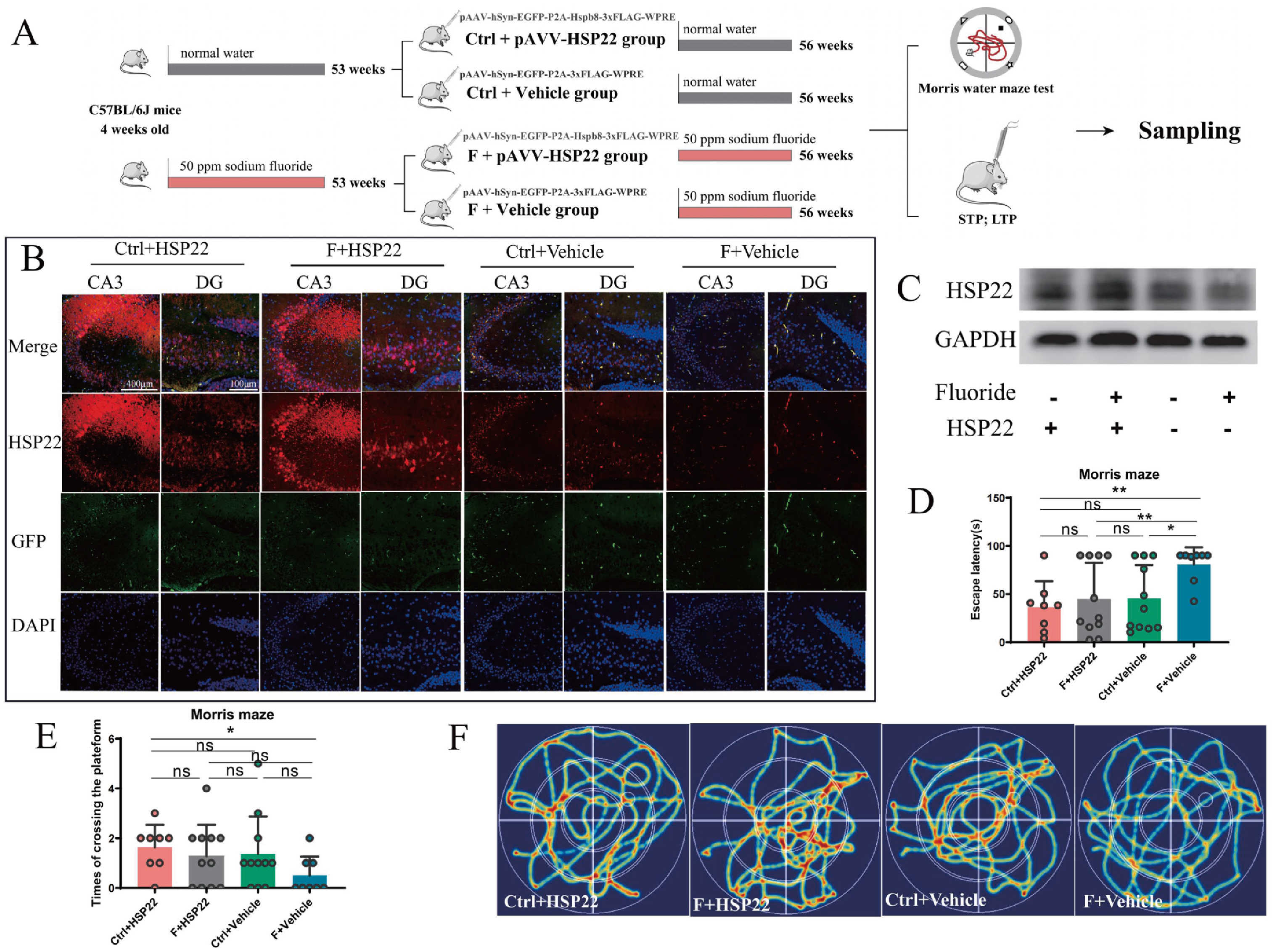
图7 海马神经元过表达Hsp22可改善长期氟暴露引起的记忆缺陷
进一步研究发现,Hsp22过表达改善氟暴露引起的突触可塑性损伤(图8A-C),以及逆转了线粒体生物发生受到抑制的情况,恢复线粒体呼吸链复合体I/II/V活性,促进ATP水平升高,改善线粒体功能障碍(图8D-E)。
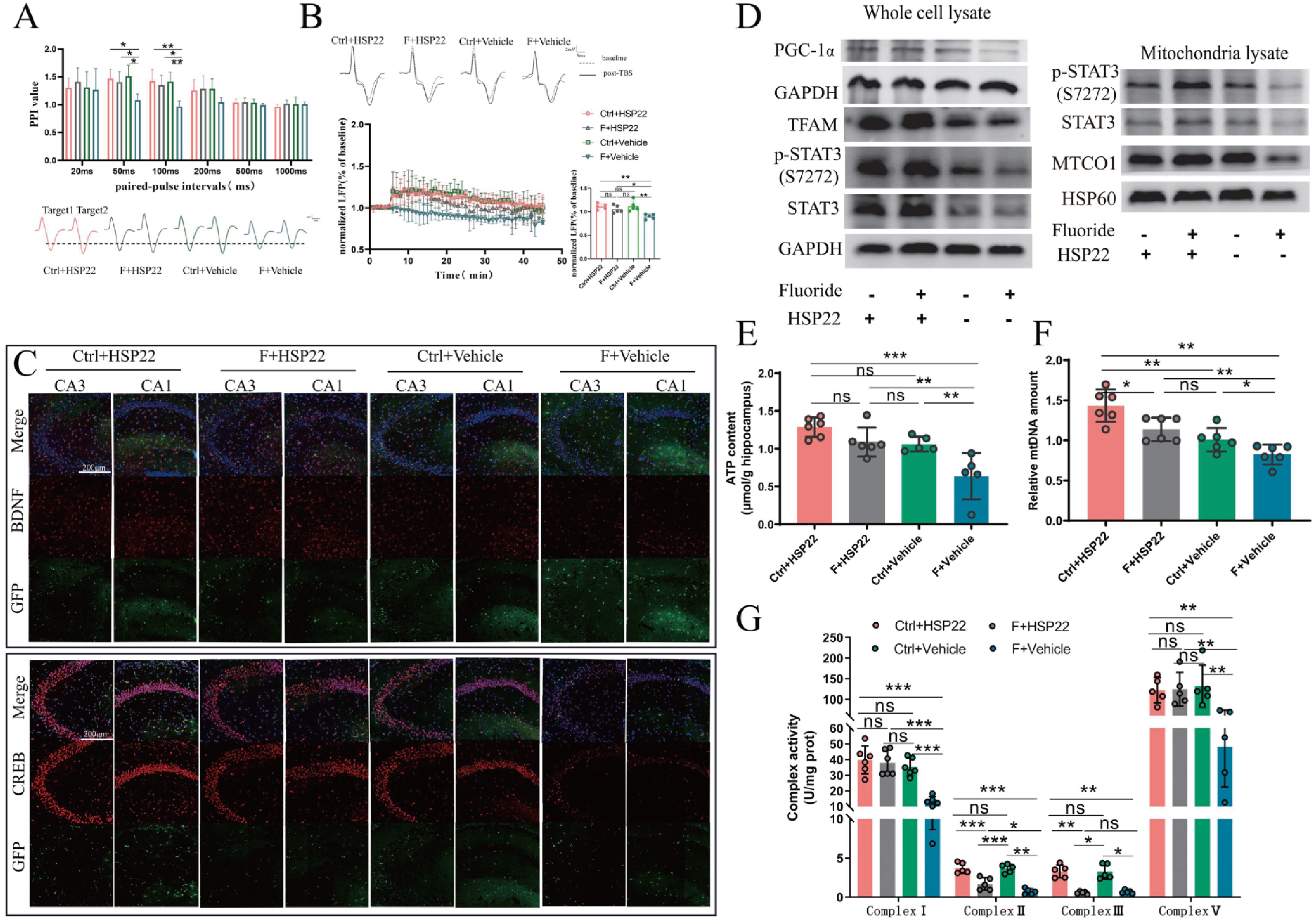
图8 海马神经元过表达Hsp22通过介导PGC-1α-TFAM和STAT3信号通路逆转长期氟暴露诱导的线粒体功能障碍
最后,研究者在小鼠海马区下调Hsp22的表达进一步验证其在氟化物诱导记忆缺陷中的作用,将pAAV-U6-shRNA(Hspb8)-CMV-EGFP-WPRE注射小鼠海马以下调Hsp22的表达(图9A-C)。MWM结果显示,氟暴露组小鼠海马下调Hsp22表达(F+Hsp22 shRNA)后,加重了小鼠空间记忆损伤,表现为更明显延长的逃避潜伏期(图9D-E)。
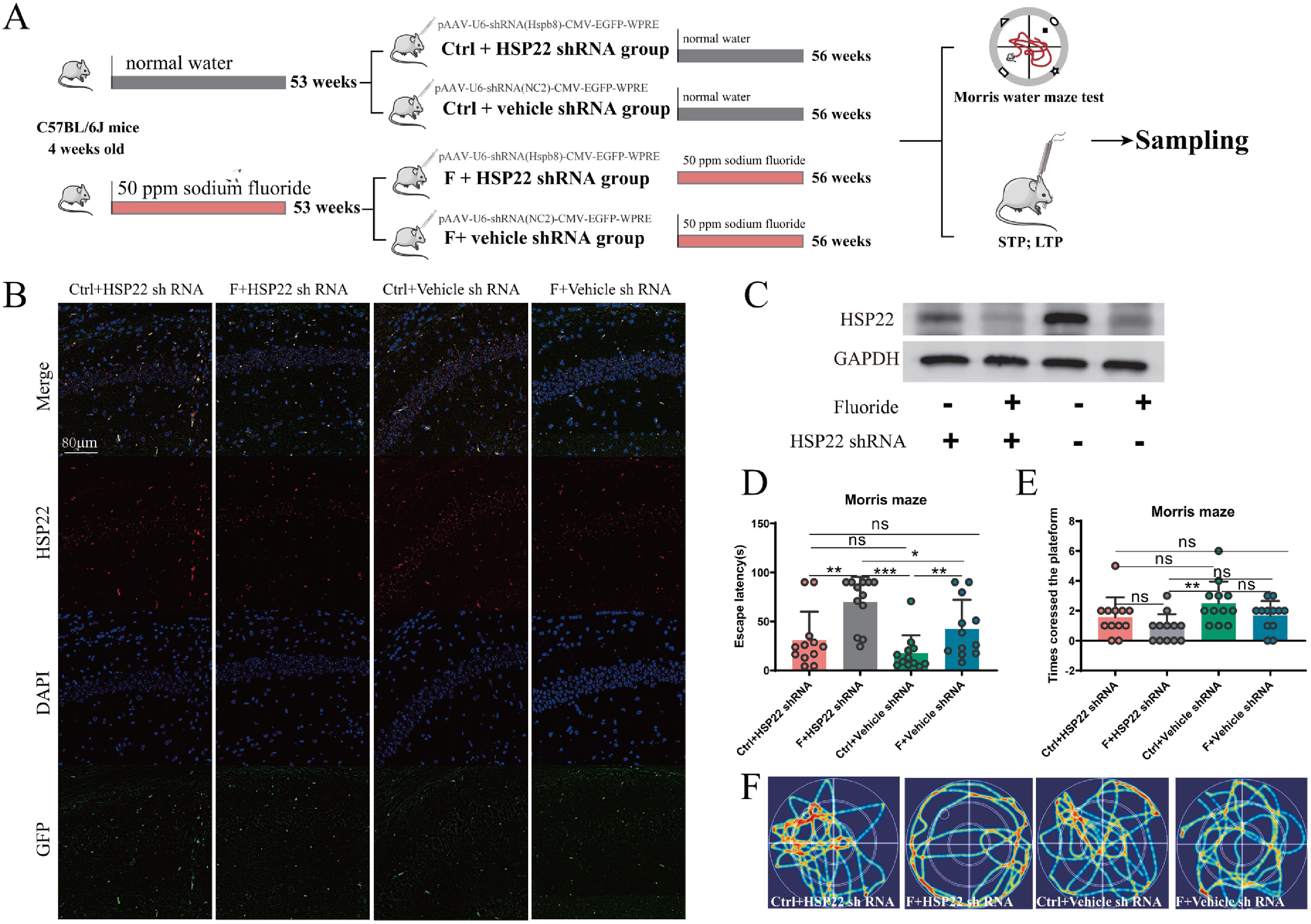
图9 Hsp22缺失加重了长期氟暴露诱发的记忆缺陷
借助分子生物学技术和电生理记录显示,Hsp22缺失对正常小鼠线粒体功能没有影响,但加重了氟暴露诱发的海马突触可塑性损伤及线粒体生物发生(图10)。
综上,这些数据提示了海马神经元中Hsp22参与氟暴露诱导的小鼠记忆缺陷机制,其通过介导PGC-1α-TFAM和NF-κβ-STAT3信号通路双向调控长期氟暴露诱发的空间记忆缺陷,海马神经元中高表达Hsp22可通过激活信号通路促进线粒体生物发生和线粒体呼吸复合物活性的增强改善氟化物所致的空间记忆缺陷;而下调Hsp22的表达通过抑制线粒体功能加剧高氟导致的认知能力下降。
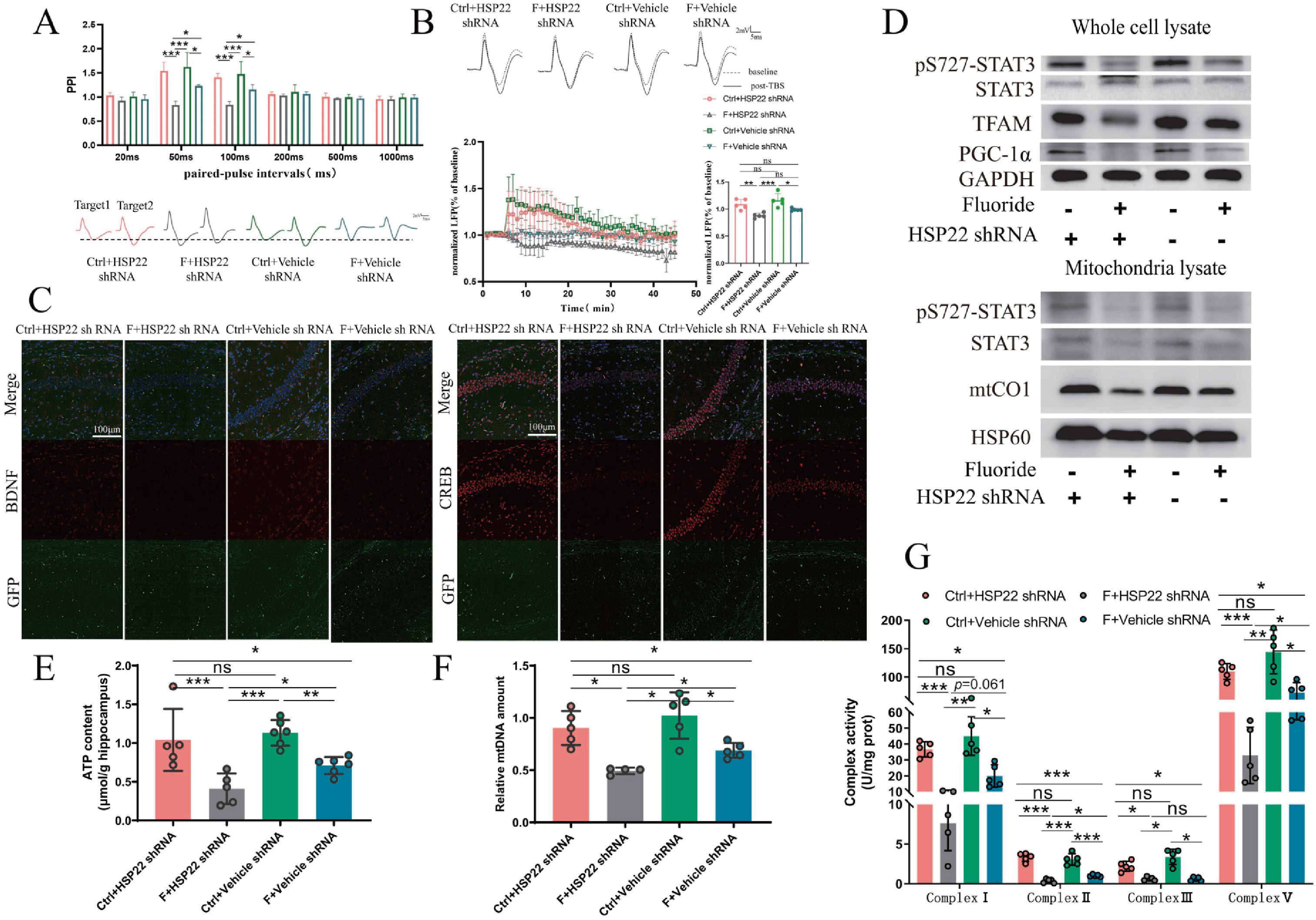
图10 Hsp22缺失加剧了长期氟暴露诱导的线粒体功能障碍
结论
本文借助分子生物学技术、行为学范式、病毒载体介导的基因功能获得/丢失、电生理记录等手段揭示了长期氟暴露对小鼠空间记忆的影响及其机制。研究发现,长期低剂量高氟饮水可致小鼠空间记忆障碍,海马线粒体结构和功能受损,且调控线粒体结构和功能的蛋白Hsp22表达受到抑制。通过AAV介导的活体特异性调控海马Hsp22表达,证实Hsp22下调介导的PGC-1α/ TFAM-mtDNA信号轴以及NF-κβ/STAT3-线粒体酶活性信号轴的抑制是氟所致空间记忆损伤的重要潜在机制。该成果为长期氟暴露导致的中枢神经系统损伤提供了理论支持,并进一步揭示了长期生活于高氟暴露地区人民的潜在健康隐患。
四川农业大学动物医学院博士辛金鸽为论文第一作者,倪学勤教授为通讯作者。电子科技大学生命科学与技术学院徐鹏教授为论文共同通讯作者。本研究得到了国家自然科学基金及四川省自然科学基金的支持。
和元生物有幸为研究者提供实验中使用的全部AAV载体,以实际行动助力神经科学研究!
原文链接:https://www.sciencedirect.com/science/article/abs/pii/S0304389423008786


扫一扫,反馈当前页面
和元生物