摘要
温州医科大学丛维涛教授研究团队在Redox Biology发表文章“The protective effects of fibroblast growth factor 10 against hepatic ischemia-reperfusion injury in mice”首次对FGF10在肝脏缺血再灌注损伤IRI中的功能及信号通路进行研究,研究发现,肝脏IRI小鼠,FGF10在再灌注期高表达;体外研究显示,FGF10主要由肝星状细胞(HSCs)分泌作用肝实质细胞。在肝脏IRI损伤早期,FGF10过表达可以减轻肝功能障碍,减少坏死和炎症,防止肝实质细胞凋亡。在肝脏IRI损伤后期,FGF10过表达可以促进肝实质细胞增殖。进一步研究发现,FGF10过表达通过激活PI3K/AKT信号通路,激活NRF2、减少氧化应激反应。
背景介绍
肝脏缺血再灌注损伤(IRI)是肝损伤过程中严重的并发症,可分为急性损伤早期和后期恢复期【1,2】。有文献报道,急性损伤早期,活性氧(ROS)过量产生可以破坏氧化还原平衡,诱导氧化还原信号通路,例如JNK1/2和NF-kB通路,导致细胞凋亡和炎症反应;恢复期,肝实质细胞生长和增殖能力提升,肝脏再生功能增强【2-4】。
纤维母细胞生长因子(FGF)在器官发育、修复、代谢和平衡中发挥重要作用【5】。间质上皮信号生长因子(FGF10)在肝脏、肾脏、脂肪发育过程中发挥重要作用,FGF10可以结合FGFR2b,通过FGFR2b参与调解下游通路;FGF10也可以结合FGFR1b,但是结合效率较低【6,7】。有研究显现,胚胎肝脏发育期,FGF10/FGFR2b信号通路激活β-catenin调节肝脏大小和肝母细胞存活率【8】;成年时期,FGF10过表达增加肝细胞,促进肝脏切除后再生【9】。然而,FGF10在肝脏IRI中的作用机制尚不清晰,因此,丛维涛教授研究团队对FGF10在肝脏IRI中的作用及机制进行了探究。
结果
肝脏IRI时期FGF10显著上调
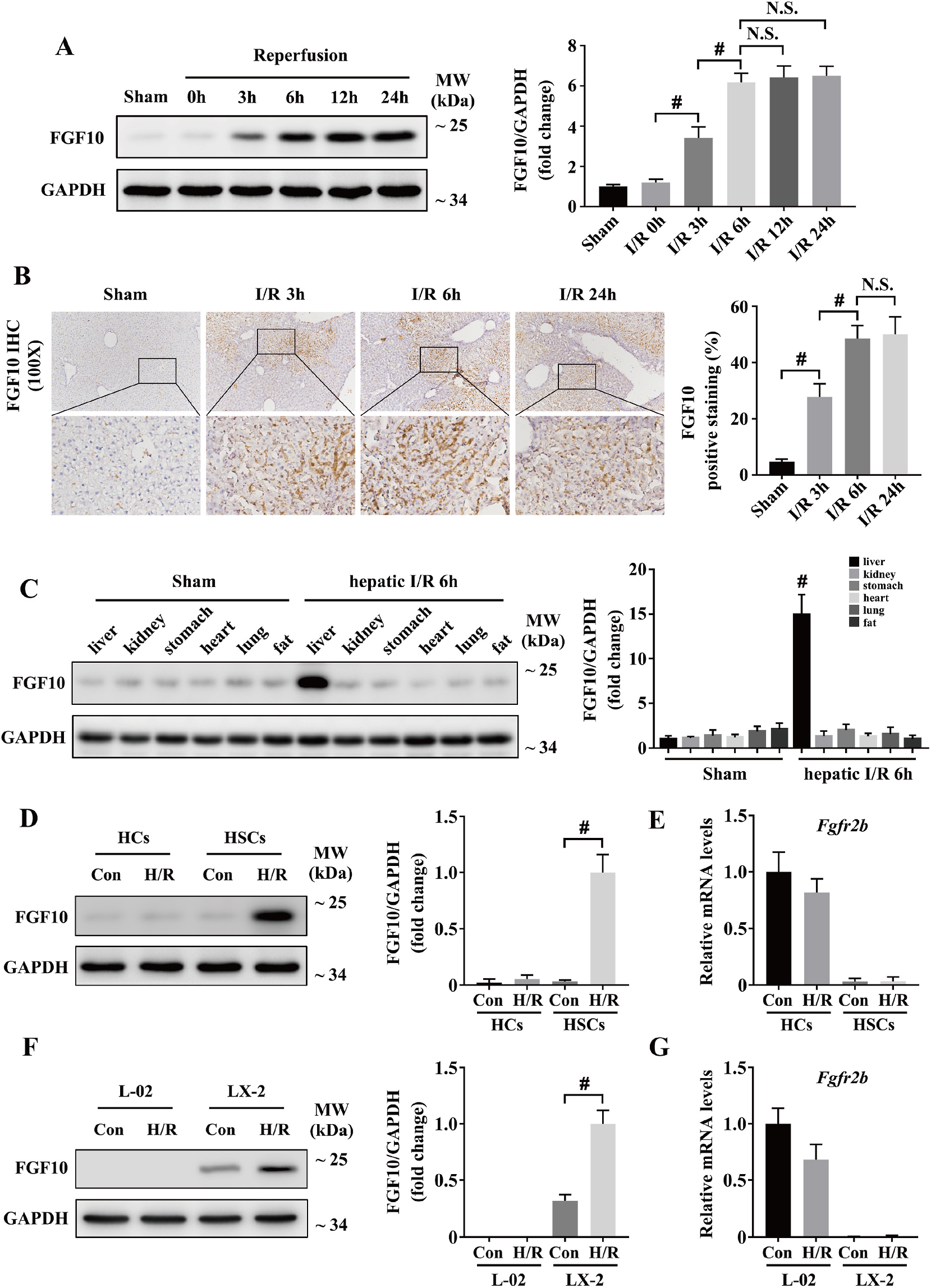
首先对FGF10与肝脏IRI相关性进行研究,研究发现,肝脏IRI术后,肝脏FGF10表达显著增高;术后6h, 肝脏FGF10表达达到高峰;并且肝脏坏死区域FGF10表达增加明显(图1A-C),说明FGF10在IRI早期表达,且在肝脏功能中发挥重要作用。有研究显示,FGF10/FGFR2b介导的间充质-上皮信号通路在多种组织中发挥重要作用;在肝脏中,有研究表明,肌成纤维细胞/星状细胞(HSCs)表达FGF10,肝实质细胞表达FGFR2b。因此,研究人员分离的原代肝实质细胞和HSCs进行研究,发现缺氧(H/R)刺激后FGF10在原代HSCs中表达上调,FGFR2b在原代肝实质细胞中表达上调,同时研究人员对FGF10和FGFR2b在肝细胞系中的表达进行验证,发现其与原代细胞结果一致(图1D-G)。
图1 肝脏IRI期间FGF10表达显著上调
ROS介导HSCs细胞FGF10表达,FGF10通过FGFR2b作用于肝实质细胞
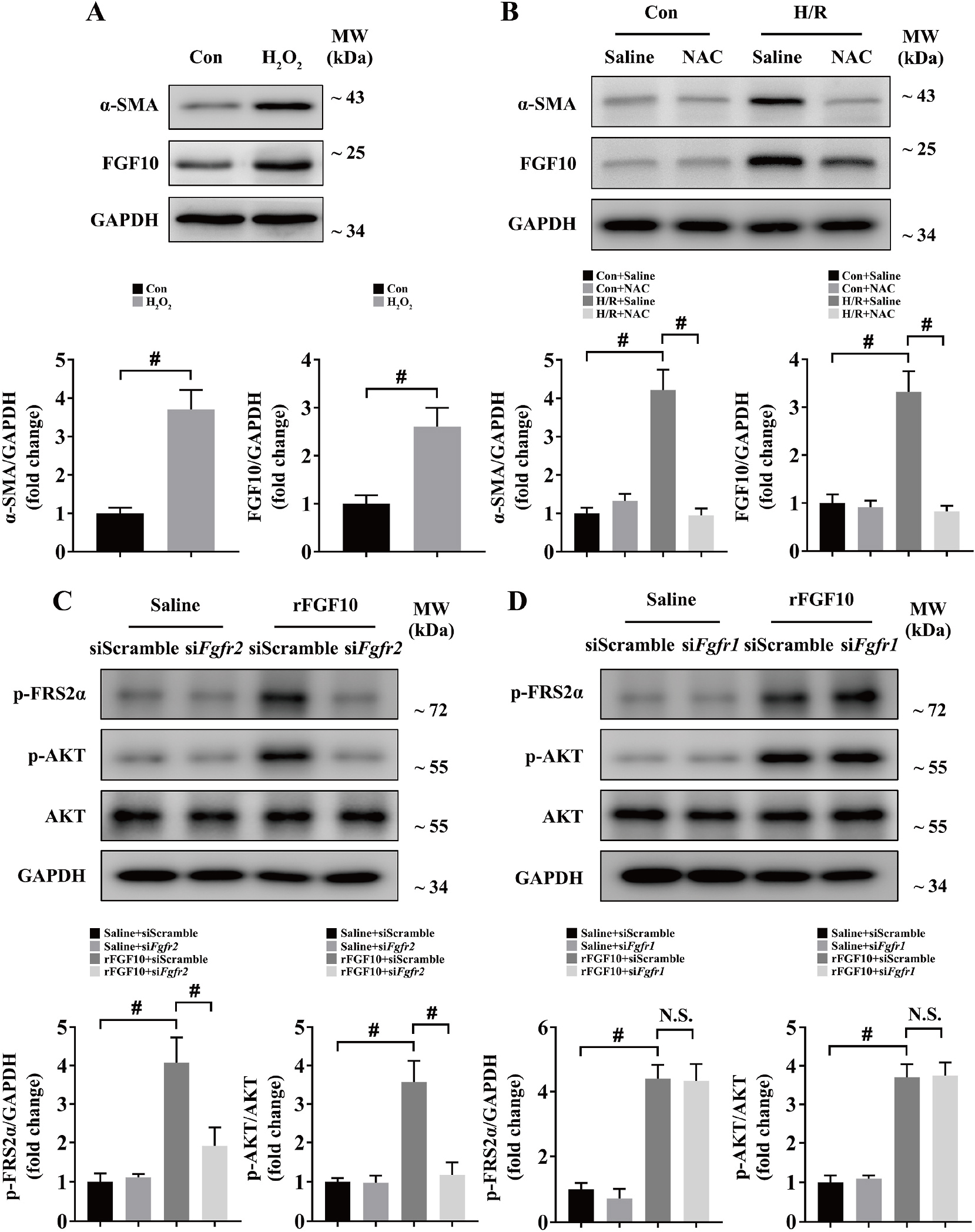
接下来,研究者对HSCs如何感知IRI损伤并释放FGF10进行研究。FGF10在IRI早期显著增加,同时ROS在此时期也起到关键作用,因此研究者猜想:ROS在肝脏IRI损伤后HSCs激活 FGF10表达过程中起重要作用。为证实这一猜想,研究者首先利用H2O2刺激小鼠原代HSCs,结果显示H2O2处理后,α-SMA和FGF10表达均显著上升,NAC抗氧化结果显示,NAC可以显著抑制H/R模型α-SMA和FGF10表达(图2A-B)。以上结果证明,肝脏IRI中ROS导致HSCs激活FGF10表达。
为了确定FGFR2b和FGFR1b的作用,在外源rFGF10处理肝实质细胞后发现pFRS2α和pAKT表达显著增高,rFGF10 处理FGFR2b敲低的肝实质细胞pFRS2α和pAKT表达被抑制,然而FGFR1b敲低后,rFGF10依然可以促进pFRS2α和pAKT表达(图2C-D)。因此,FGF10极有可能通过FGFR2b作用肝实质细胞。
图2 ROS介导肝星状细胞FGF10表达,FGF10 通过FGFR2b作用肝实质细胞
FGF10改善肝脏IRI过程中肝损伤调节AKT激活
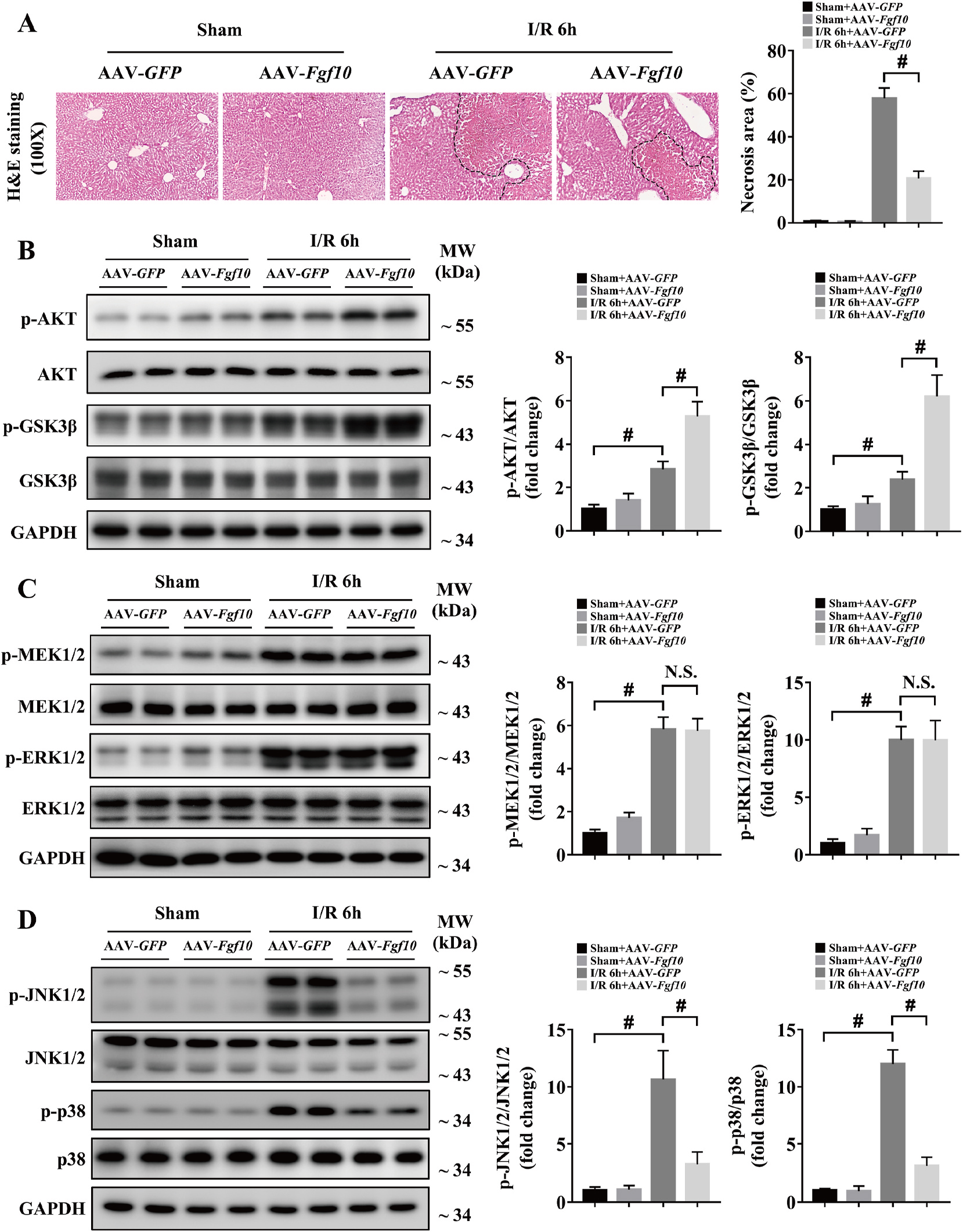
为了确定FGF10在肝脏IRI中的作用,研究人员利用AAV病毒载体对肝脏中的FGF10进行基因操作。研究发现,肝脏IRI后6h肝脏坏死严重,肝脏中过表达FGF10在肝脏IRI中起到保护作用,减少肝脏的坏死面积,敲低FGF10表达加重肝脏IRI后的肝脏坏死面积(图3A&图4A)。
有研究显示,AKT信号通路在肝脏IRI过程中促进肝细胞生存和改善肝脏损伤【10】,另外PI3K/AKT信号通路是FGF10信号下游重要的靶点【6】。因此,研究者对FGF10和AKT激活的关系进行研究,研究发现FGF10过表达磷酸化AKT和GSK3β均增加,然而,敲低FGF10结果与之相反(图3B&图4B)。因此FGF10在肝脏IRI过程中AKT激活起重要作用。
此外,MAPK信号通路在调节肝脏IRI中发挥重要作用【11】,对MAPK家族在肝脏IRI的作用进行研究发现,MAPK成员在肝脏IRI后的激活均有显著变化;然而,FGF10对MEK/ERK激活没有显著影响,JNK1/2与p38的磷酸化对FGF10有明显的依赖性(图3C-D&图4C-D)。
图3 FGF10过表达促进肝脏IRI过程中AKT激活改善肝脏损伤
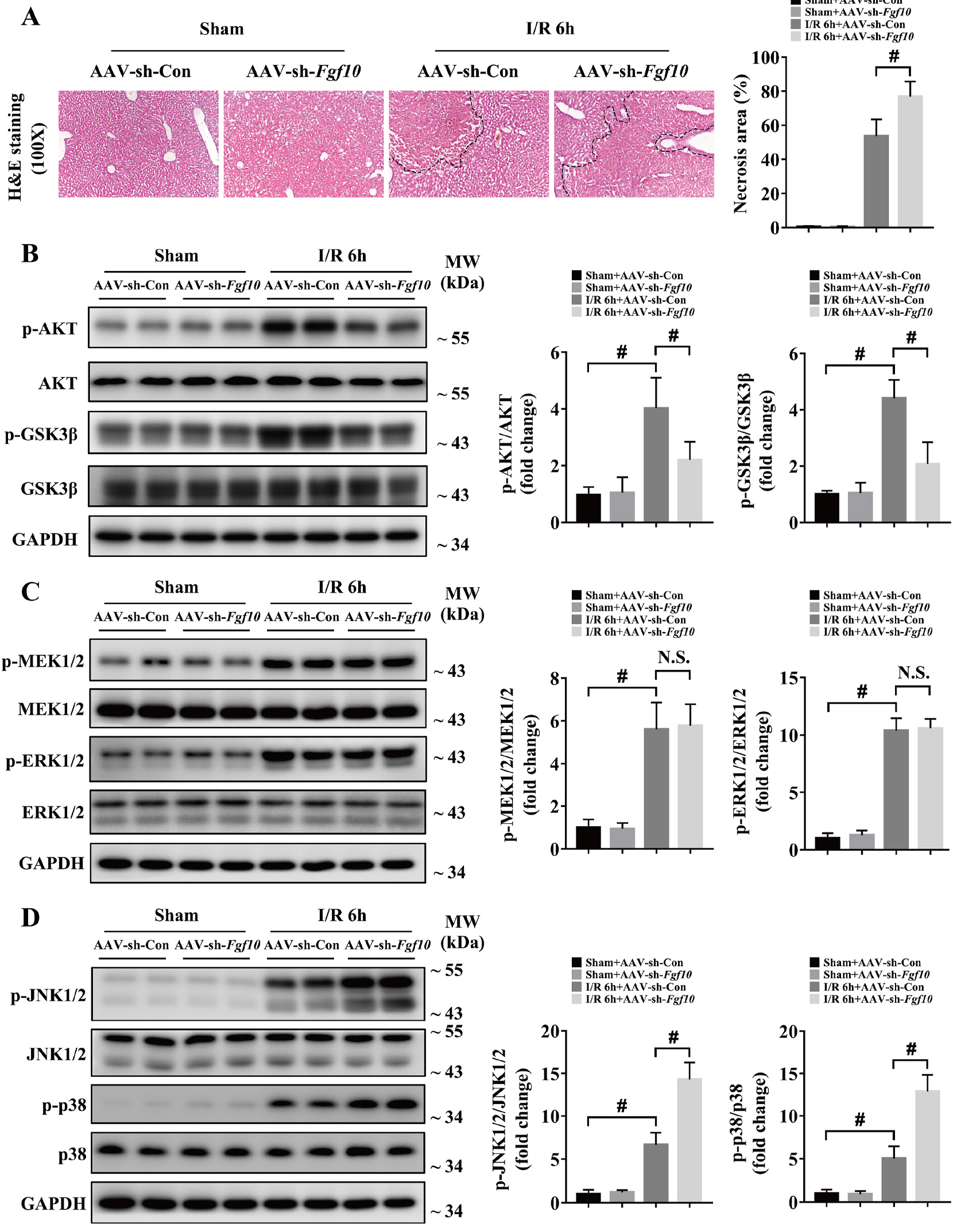
图4 干扰FGF10表达抑制肝脏IRI过程中AKT激活加重肝脏损伤
FGF10保护损伤期肝细胞凋亡促进修复期肝细胞增殖
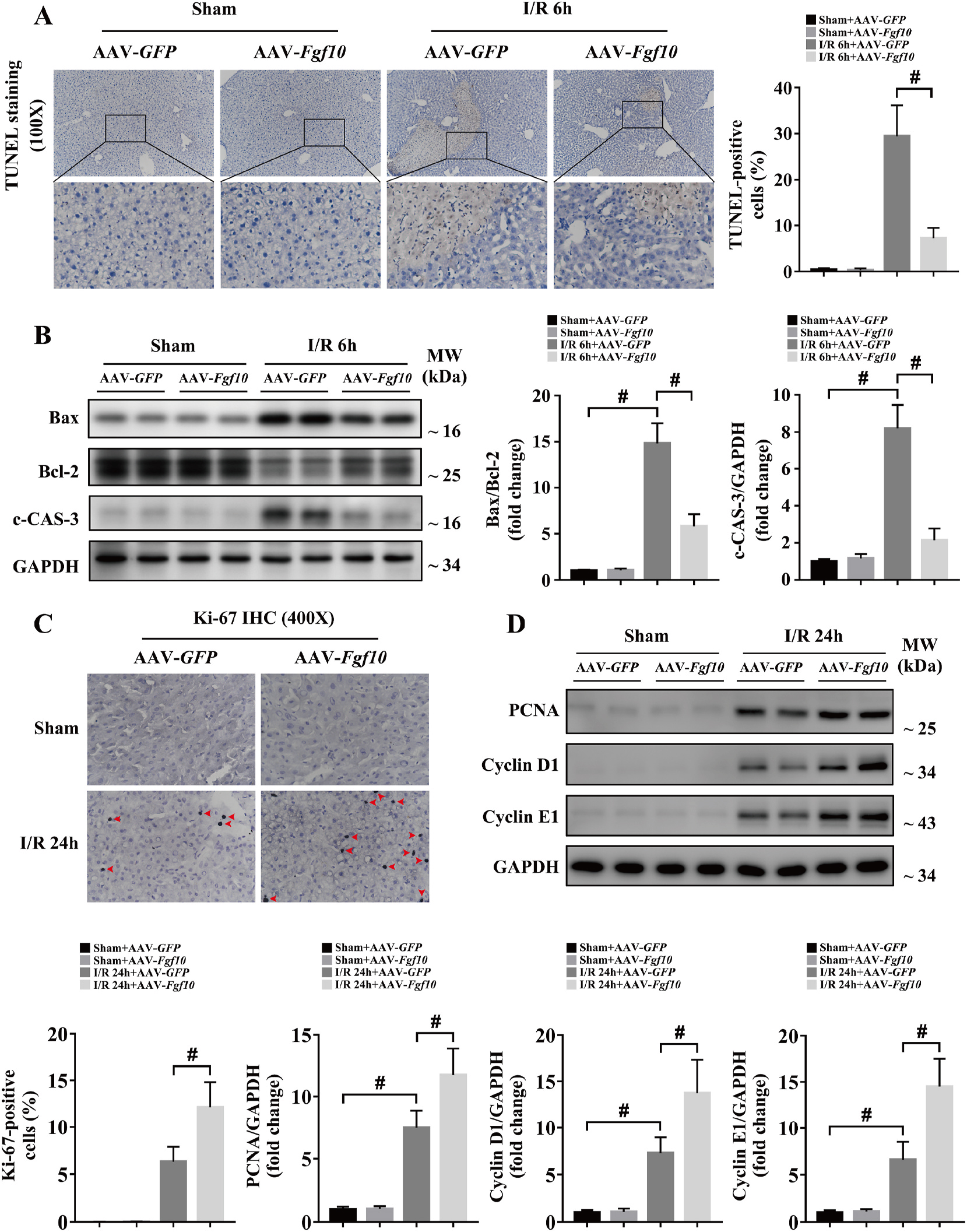
细胞凋亡是造成肝脏IRI损伤的重要原因,因此研究者对FGF10在肝脏IRI细胞凋亡与增殖进行研究。研究发现,肝脏IRI术后6h肝脏细胞凋亡显著增多,并且c-CAS-3与促凋亡基因Bax/抑制凋亡基因Bcl-2显著增加;肝脏IRI恢复期,肝细胞增殖增加;FGF10过表达抑制肝细胞凋亡、促进肝细胞增殖(图5);干扰FGF10表达则与之相反(图6)。因此,FGF10在肝脏IRI后细胞增殖调控中发挥重要作用。
图5 FGF10过表达保护肝脏IRI损伤期肝细胞凋亡促进修复期细胞增殖
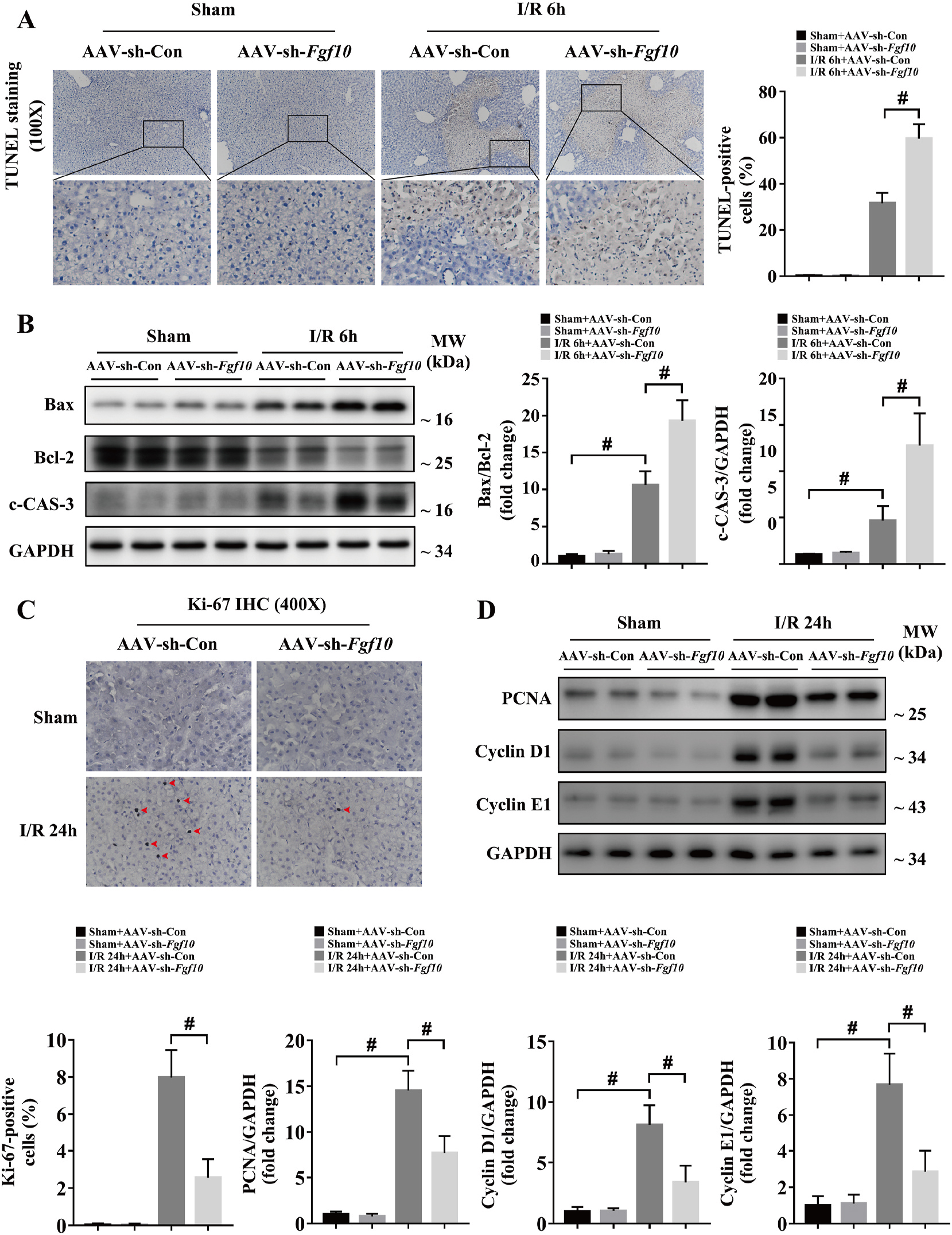
图6 干扰FGF10表达加重肝脏IRI损伤期细胞凋亡抑制修复期细胞增殖
FGF10 抑制肝脏IRI免疫反应
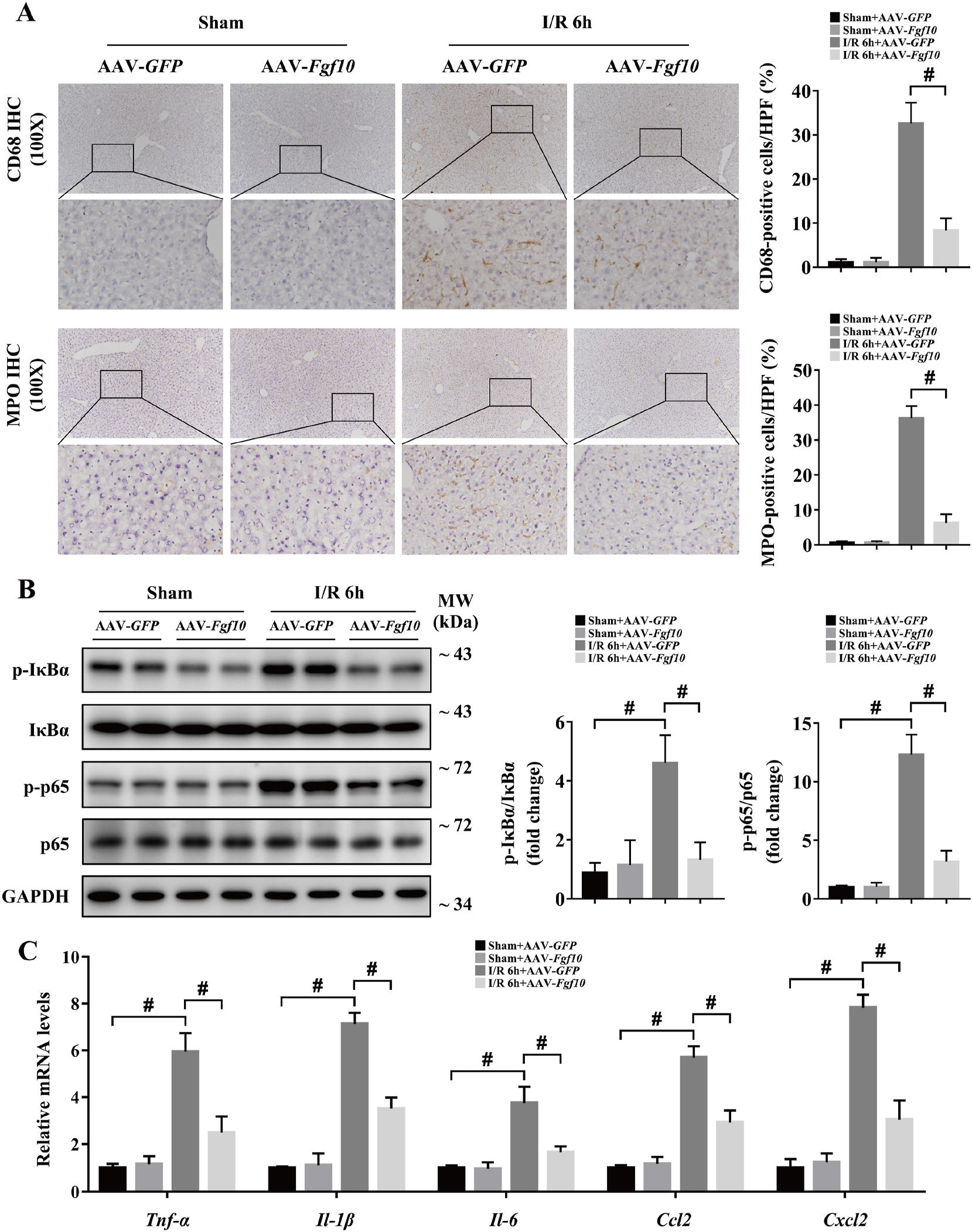
肝脏IRI过程中组织损伤和肝功能与恢复会引发炎症反应,因此研究人员对肝脏IRI过程中的炎症反应进行研究。研究发现,肝脏IRI损伤6h后,巨噬细胞标志物CD68和中性粒细胞标志物MPO均显著增加,NF-KB信号通路IkBα和p65磷酸化增加,多种炎症因子和化学因子也显著增加;FGF10过表达抑制肝脏损伤后CD68和MPO水平、抑制IkBα和p65磷酸化以及抑制炎症因子和化学因子水平(图7);干扰FGF10表达结果则相反(图8)。以上结果说明,FGF10在肝脏IRI起抗炎作用。
图7 FGF10过表达抑制肝脏IRI免疫应激反应
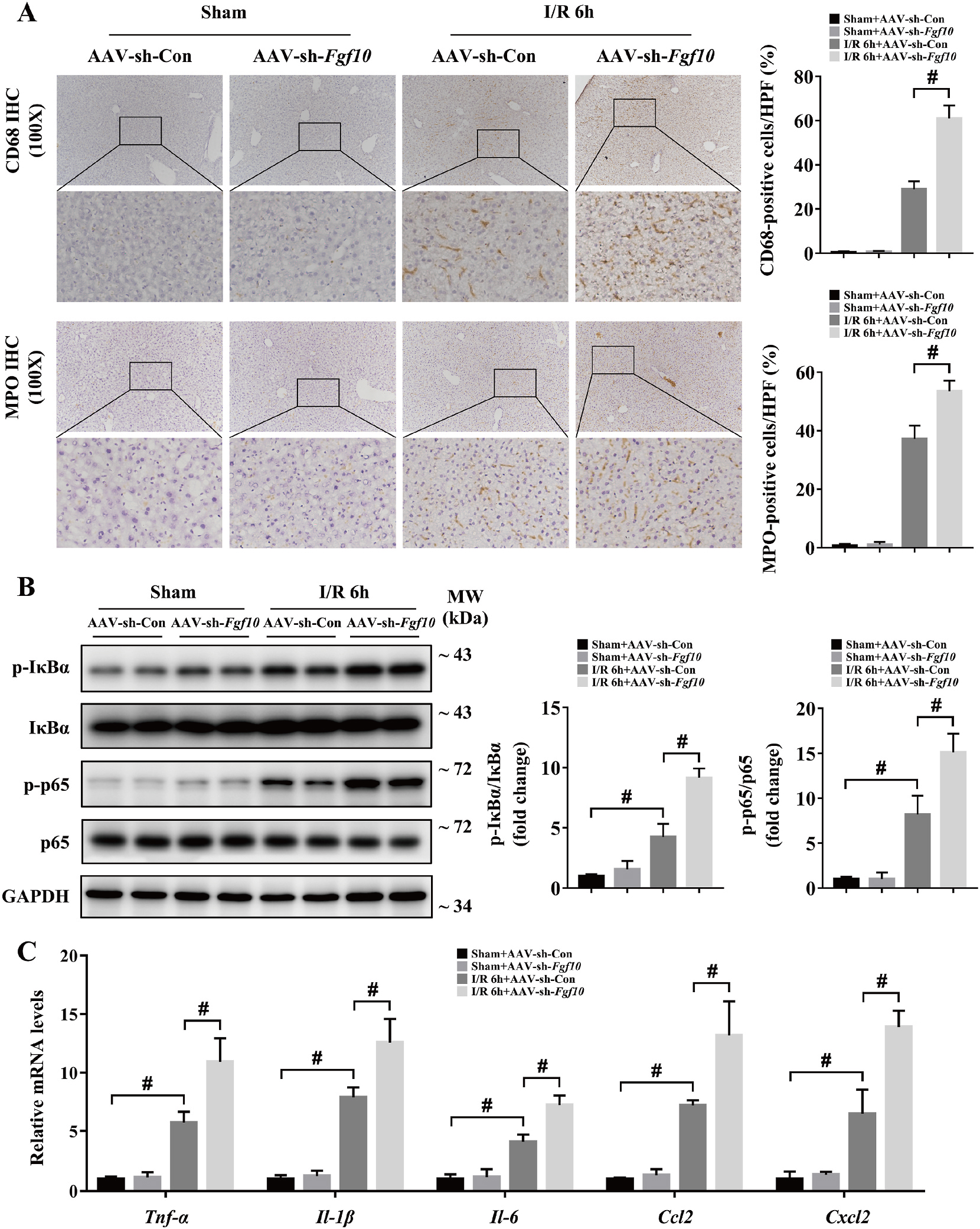
图8 干扰FGF10表达加重肝脏IRI免疫应激反应
FGF10抑制肝脏IRI氧化应激反应、通过AKT信号通路激活NRF2
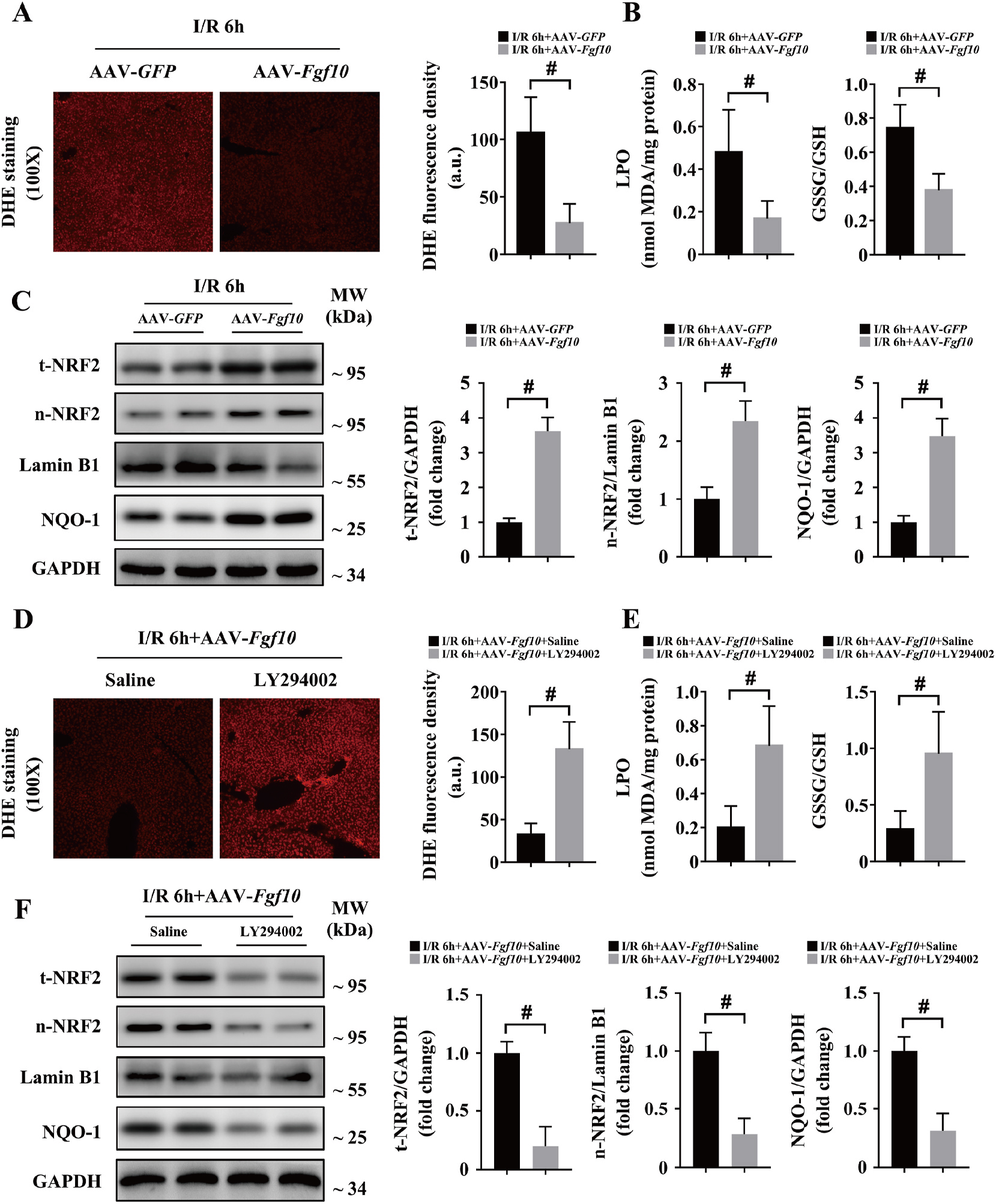
因为前期研究发现肝脏IRI损伤前期FGF10表达增高并且ROS诱导HSCs FGF10表达增加,所以研究人员对肝脏IRI后FGF10表达对氧化应激的作用进行了研究。研究发现,肝脏IRI后6h过表达FGF10抑制ROS产生,LPO、GSSG/GSH水平降低(图9A-B),说明FGF10抑制肝脏IRI过程中ROS产生。NRF2作为一种强抗氧化剂,FGF10过表达肝脏IRI后核内NRF2和总NRF2表达均有显著增加,且NRF2下游NQO-1也显著增加(图9C)。NRF2作为AKT的下游靶点,因此利用PI3K抑制剂(LY294002)抑制PI3K/AKT信号通路,结果发现,LY294002抑制FGF10对肝脏IRI的抗氧化作用(图9D-F)。所以,过表达FGF10通过PI3K/AKT信号通路激活NRF2对肝脏IRI起保护作用。
图9 FGF10抑制肝脏IRI氧化应激、通过AKT信号通路激活NRF2
FGF10介导的肝脏IRI肝细胞保护依赖NRF2
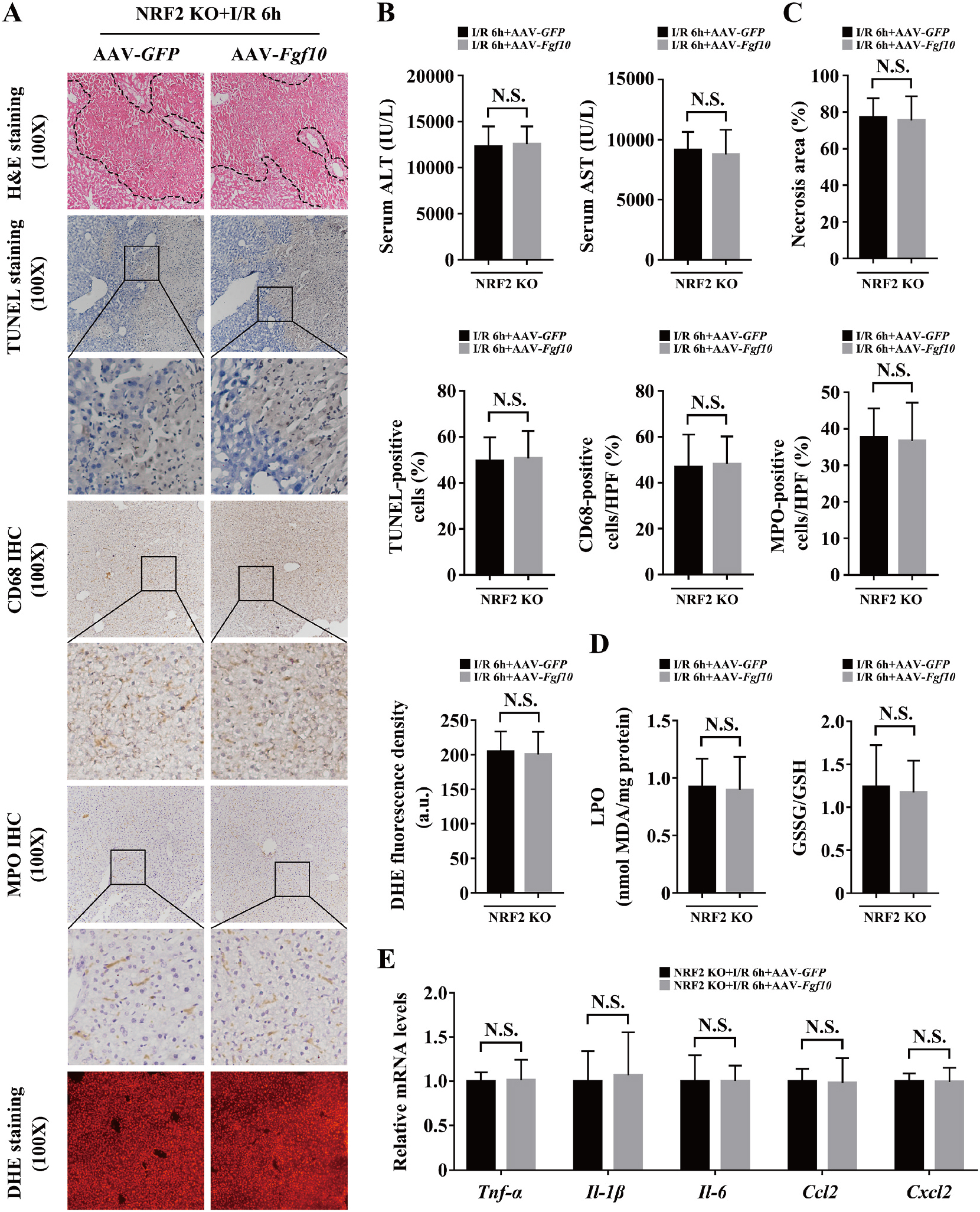
为确定FGF10介导的肝脏IRI保护作用是否NRF2依赖,所以利用AAV载体过表达FGF10对NRF2敲除小鼠肝脏IRI进行研究发现,过表达FGF10对NRF2敲除小鼠的ALT/AST、细胞凋亡、免疫细胞、ROS和多种因子水平均没有明显的变化(图10)。
图10 FGF10介导的肝脏IRI肝细胞保护作用依赖NRF2
小结
FGF10在肝脏IRI中起保护作用。FGF10诱导及AKT 依赖的NRF2激活促进肝脏IRI损伤后的肝脏修复及维持肝脏内平衡。以上这些研究结果可以加深对FGF10在肝脏调节作用机制,并且为今后肝脏IRI治疗提供了潜在的治疗靶点。
参考文献:
【1】S. Kuboki, T. Shin, N. Huber, et al., Peroxisome proliferator-activated receptor-gamma protects against hepatic ischemia/reperfusion injury in mice, Hepatology 47 (2008) 215–224.
【2】T. Konishi, A.B. Lentsch, Hepatic ischemia/reperfusion: mechanisms of tissue injury, repair, and regeneration, Gene Expr. 17 (2017) 277–287.
【3】H.C. Yu, H.Y. Qin, F. He, et al., Canonical notch pathway protects hepatocytes from ischemia/reperfusion injury in mice by repressing reactive oxygen species production through JAK2/STAT3 signaling, Hepatology 54 (2011) 979–988.
【4】T. Uehara, B. Bennett, S.T. Sakata, et al., JNK mediates hepatic ischemia reperfusion injury, J. Hepatol. 42 (2005) 850–859.
【5】N. Itoh, D.M. Ornitz, Fibroblast growth factors: from molecular evolution to roles in development, metabolism and disease, J. Biochem. 149 (2011) 121–130.
【6】J. Watson, C. Francavilla, Regulation of FGF10 signaling in development and disease, Front. Genet. 9 (2018) 500.
【7】 X. Zhang, O.A. Ibrahimi, S.K. Olsen, et al., Receptor specificity of the fibroblast growth factor family. The complete mammalian FGF family, J. Biol. Chem. 281 (2006) 15694–15700.
【8】T. Berg, C.B. Rountree, L. Lee, et al., Fibroblast growth factor 10 is critical for liver growth during embryogenesis and controls hepatoblast survival via beta-catenin activation, Hepatology 46 (2007) 1187–1197.
【9】S. Utley, D. James, N. Mavila, et al., Fibroblast growth factor signaling regulates the expansion of A6-expressing hepatocytes in association with AKT-dependent β-catenin activation, J. Hepatol. 60 (2014) 1002–1009.
【10】K. Izuishi, A. Tsung, M.A. Hossain, et al., Ischemic preconditioning of the murine liver protects through the Akt kinase pathway, Hepatology 44 (2006) 573–580.
【11】Z.Z. Yan, Y.P. Huang, X. Wang, et al., Integrated omics reveals tollip as an regulator and therapeutic target for hepatic ischemia-reperfusion injury in mice, Hepatology 70 (2019) 1750–1769.

和元生物为代谢相关研究提供整体研究方案,从动物造模、基因筛选、基因操作、病毒包装、生理病理检测、机制探究、到观察验证等一站式服务。用专业、认真、严谨的科学态度为代谢研究助力。