
Nat. Metab | 山东大学于晓团队,北京大学孙金鹏团队联合焦宁团队发现治疗糖尿病的新型GPR132拮抗剂
糖尿病是全球对人类健康有害的且最难根治的代谢疾病之一。最近的研究表明, 由胰岛巨噬细胞重编程引起的慢性炎症显著促进了肥胖向Ⅱ型糖尿病的转化。重编程的胰岛巨噬细胞不仅破坏了胰岛素的分泌能力, 而且导致β细胞增生和变性。尽管已经有研究表明, 胰岛内巨噬细胞的增殖可能受到细胞间接触和β细胞释放的ATP调节, 但在脂肪酸或葡萄糖水平升高的情况下, 胰岛衍生的特异性局部信号传导和胰岛内巨噬细胞重编程的确切机制仍不清楚。
G蛋白耦联受体(GPCRs)是一个“和G蛋白连接才能工作的受体”, 它通常位于细胞膜上并且参与大部分生理功能的调节。肥胖和糖尿病的发生经常伴随着脂质过氧化物的增加, 脂质过氧化物通常可以激活GPCR发挥作用。有研究表明胰岛内源性脂肪酸通过激活GPR120可以调控胰岛δ细胞-β细胞环路从而激活下游信号通路。GPR132是GPCRs的一种, 可识别溶血磷脂酰胆碱, 环氧二十碳三烯酸和9(S)-HODE, 然而GPR132在胰岛巨噬细胞中扮演的角色仍未得到深入研究。
2023年9月, 山东大学于晓团队,北京大学孙金鹏团队联合焦宁团队通过冷冻电镜对GPR132-鸟嘌呤核苷酸结合蛋白(Gi)与其配体的结构进行解析, 发现了GPR132与其配体识别和激活的结构机制,而且开发了GPR132定向选择性激动剂NOX-6-1。此外,研究团队通过将弱激动剂NOX-6-1中酰胺连接改为磺酰胺连接,发现其不仅消除了Gi的活性,并拮抗了内源性配体激活Gi活性。研究团队采用分子动力学模拟、FlAsH-BRET和生化实验相结合的方法来评估化合物的结合位置,发现了GPR132拮抗剂与激动剂之间转变的关键作用残基,最终找到了GPR132的强效选择性拮抗剂NOX-6-18(IC50约为14nM)。通过研究发现NOX-6-18能够调节胰岛巨噬细胞重编,减少体重增加,促进葡萄糖代谢。

1.GPR132参与胰岛巨噬细胞重编程
首先, 研究者发现高脂饮食小鼠的胰岛巨噬细胞中的炎症因子显著上调, 并且用有机溶剂裂解提取的胰岛巨噬细胞的炎症因子表达水平显著高于甲醇溶解提取的部分, 说明这些炎症因子与脂质代谢有关, 通过质谱分析, 研究者发现9(S)-HODE,二十二碳六烯酸和花生四烯酸水平在高脂饮食小鼠的胰岛组织中显著升高。然而, 只有9(S)-HODE能够促进胰岛巨噬细胞中的炎症因子的表达, 并且促进巨噬细胞增值, 与此同时, 9(S)-HODE的增加会导致GPR132的高表达。而胰岛巨噬细胞特异性敲除GPR132会逆转9(S)-HODE诱导的炎症因子的表达。这些结果表明GPR132在内源性脂质刺激或高脂饮食压力下会发生巨噬细胞重编程。
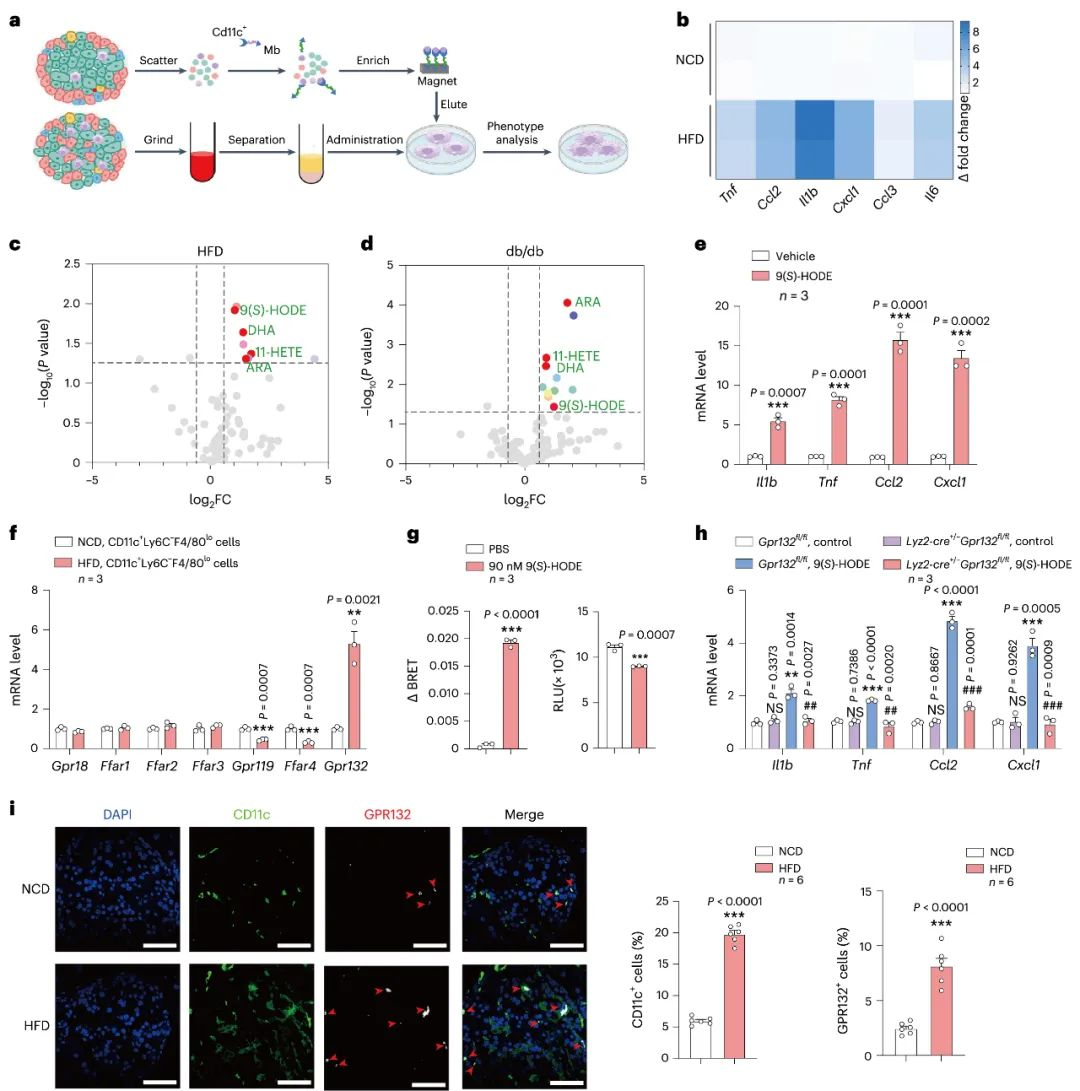
图1 胰岛巨噬细胞重编程过程中GPR132信号通路的上调
2.GPR132-Gi信号有助于胰岛巨噬细胞的重编程
为了进一步研究GPR132-Gi与巨噬细胞重编程的关系, 用9(S)-HODE处理胰岛巨噬细胞, 发现胰岛巨噬细胞中的吞噬能力增加, 炎症因子Il1b, Tnf, Ccl2和Cxcl1 mRNA水平显著升高。然而经Gi抑制剂百日咳毒素 (PTX) 预处理后,由9(S)-HODE引起的胰岛巨噬细胞炎症反应明显降低。同样, 使用Cre品系动物+DIO病毒 (pADV-mCMV-DIO-pertussis toxin subunit 1 (TOX1)-P2A-EGFP) 在胰腺巨噬细胞过表达PTX也出现了同样的效果。这些结果表明GPR132在胰岛巨噬细胞中介导的功能参与了9(S)-HODE诱导的胰岛炎症反应和胰岛巨噬细胞重编程。
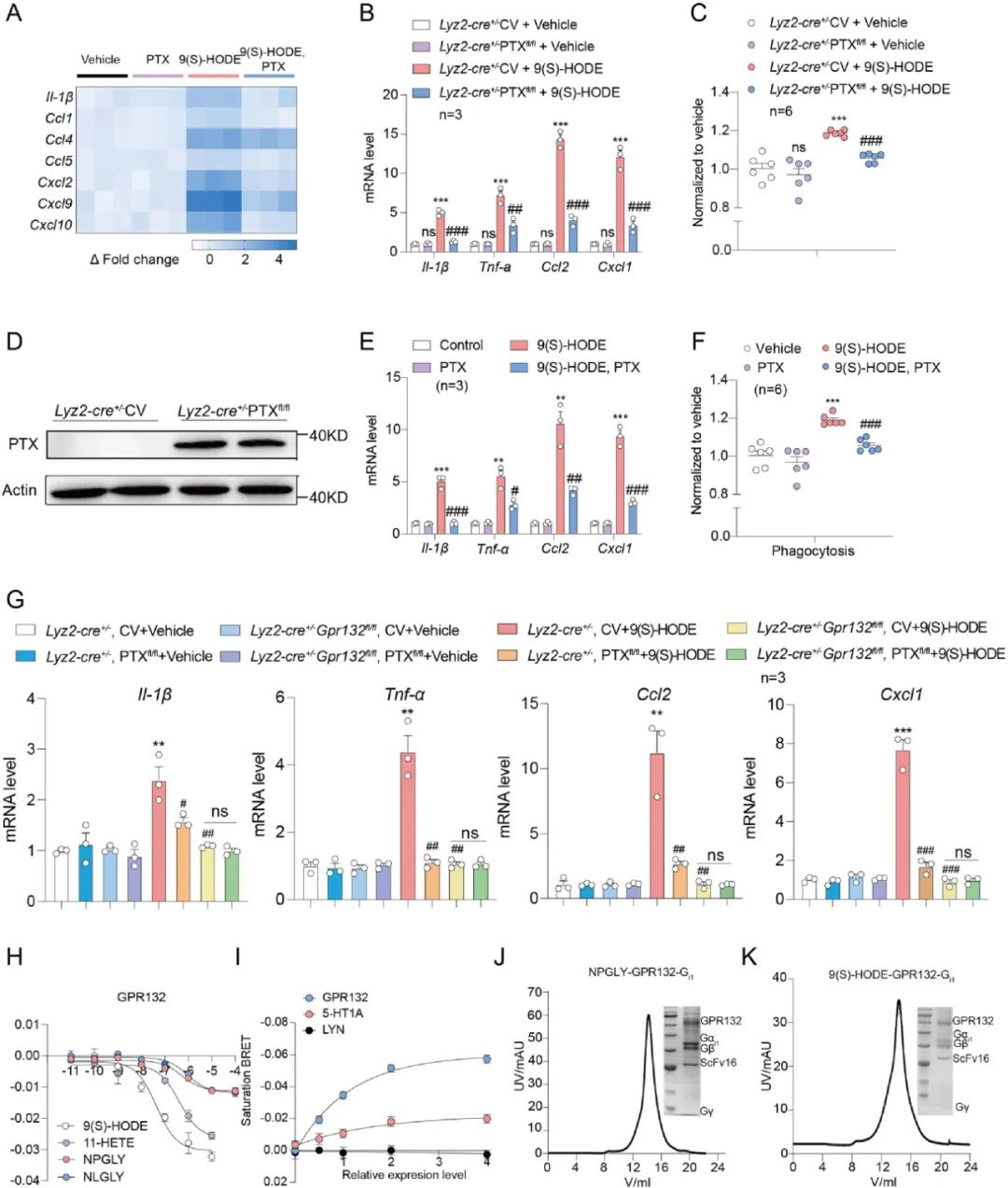
图2 GPR132- Gi信号有助于胰岛巨噬细胞重编程和GPR132复合物样品制备
3.冷冻电镜对apo-GPR132–Gi1, NPGLY–GPR132–Gi1和9(S)-HODE–GPR132–Gi1复合物的结构解析
研究团队利用冷冻电镜解析了NPGLY-GPR132-Gi和9(S)-HODE–GPR132–Gi1的结构,通过分析发现,两种内源性配体通过两个不同的口袋与GPR132受体结合, NPGLY占据配体结合口袋左侧使口袋呈“L”形, 而9(S)-HODE具有更深的配体结合位置。虽然两种配体具有不同的结合口袋, 但是两种激动剂9(S)-HODE和NPGLY具有相似的激活机制, 都是通过与GPR132的Y1273.37和Y2005.39发生直接交互作用。此外,用丙氨酸残基替换GPR132的F2085.47, Y2586.51和H2596.52残基会损害GPR132对NPGLY或9(S)-HODE的激活作用, 说明由Y2586.51-F2085.47-H2596.32-F2556.48组成的疏水链的构象重排是内源性激动剂激活GPR132的共同机制。这些结果表明GPR132配体口袋的可塑性以及对NPGLY或9(S)-HODE结合和激活至关重要的关键残基的识别可能有助于合理设计选择性GPR132激动剂或拮抗剂。
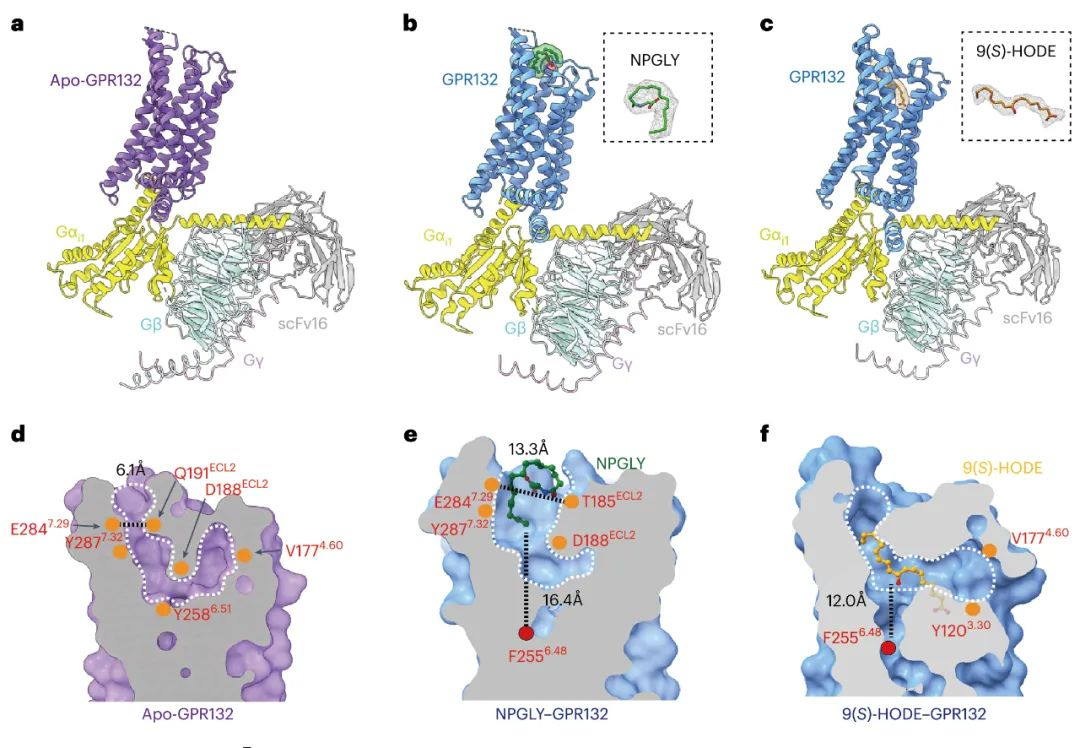
图3 GPR132–Gi的冷冻电镜结构
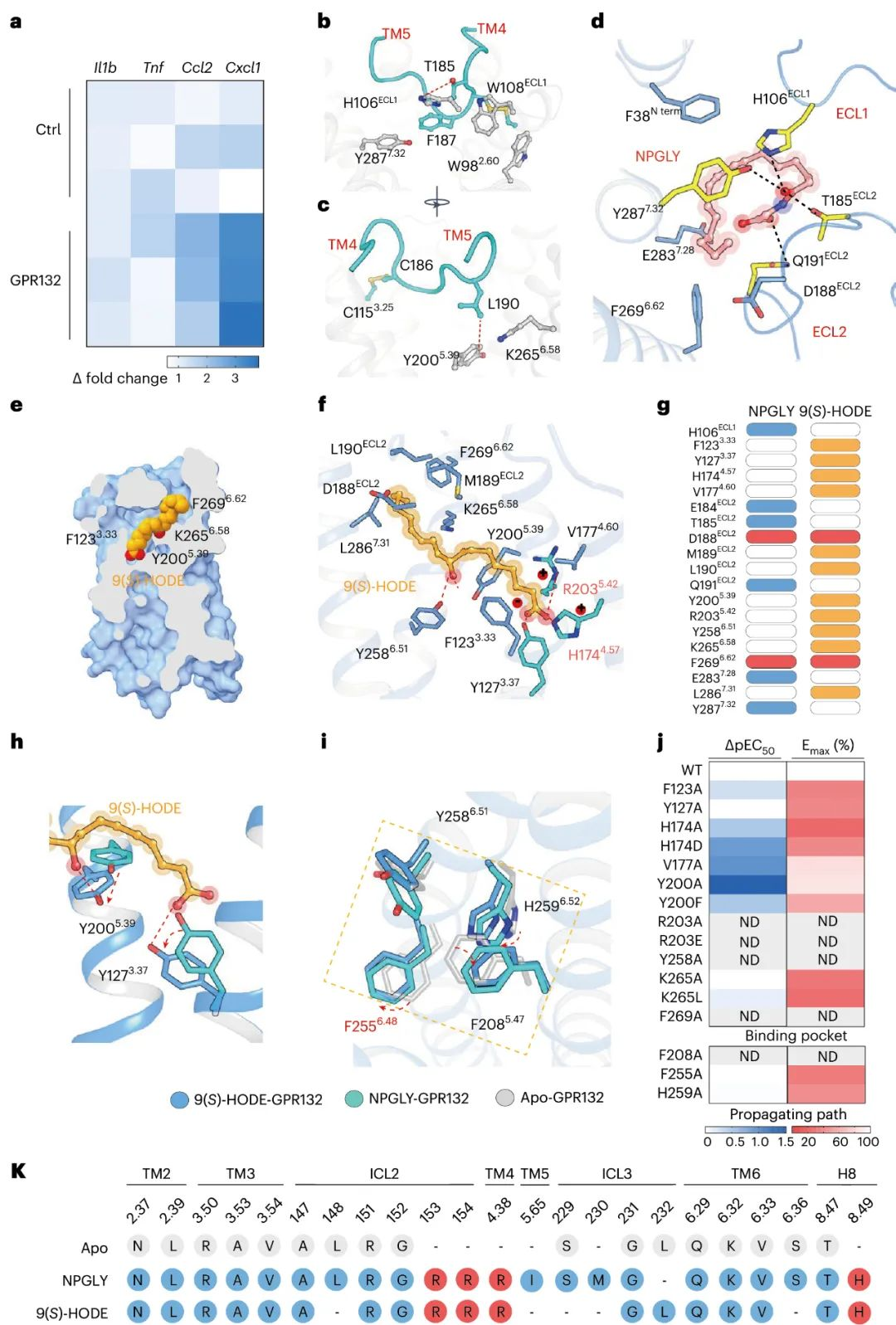
图4 GPR132的组成活性以及NPGLY和9(S)-HODE对GPR132的结合和激活的结构基础
4.基于GPR132结构的分子化合物的筛选
GPR132的选择性激动剂有助于及时识别GPR132在特定生理过程中所起的精确作用,并且可以通过对激动剂的修饰衍生出GPR132的拮抗剂。因此,研究者进行了计算机辅助虚拟筛选, 以确定调节GPR132的潜在的活性候选化合物。通过SiteMap算法, 以及分子动力学模拟,分别计算了两个“正构位点”残基的能量贡献, 并结合突变验证,确定了配体设计的热点残基。另外, 研究者通过NOX多样性小分子化合物库,发现苗头化合物NOX-6-1(EC50约为1124nM)。通过药物设计, 药物化学合成以及药理学表征,最终成功地发现了GPR132选择性激动剂NOX-6-7(EC50约为30nM)。接下来,研究者将NOX-6-7注入了小鼠胰岛巨噬细胞中, 发现它能够诱导胰岛巨噬细胞重编程,并增加胰岛巨噬细胞的吞噬能力。然而, 这些作用会被Gi抑制剂-PTX消除。这些结果表明,NOX-6-7是评估GPR132下游Gi信号功能的有用分子,GPR132中的Gi信号在胰岛稳态中起重要作用。
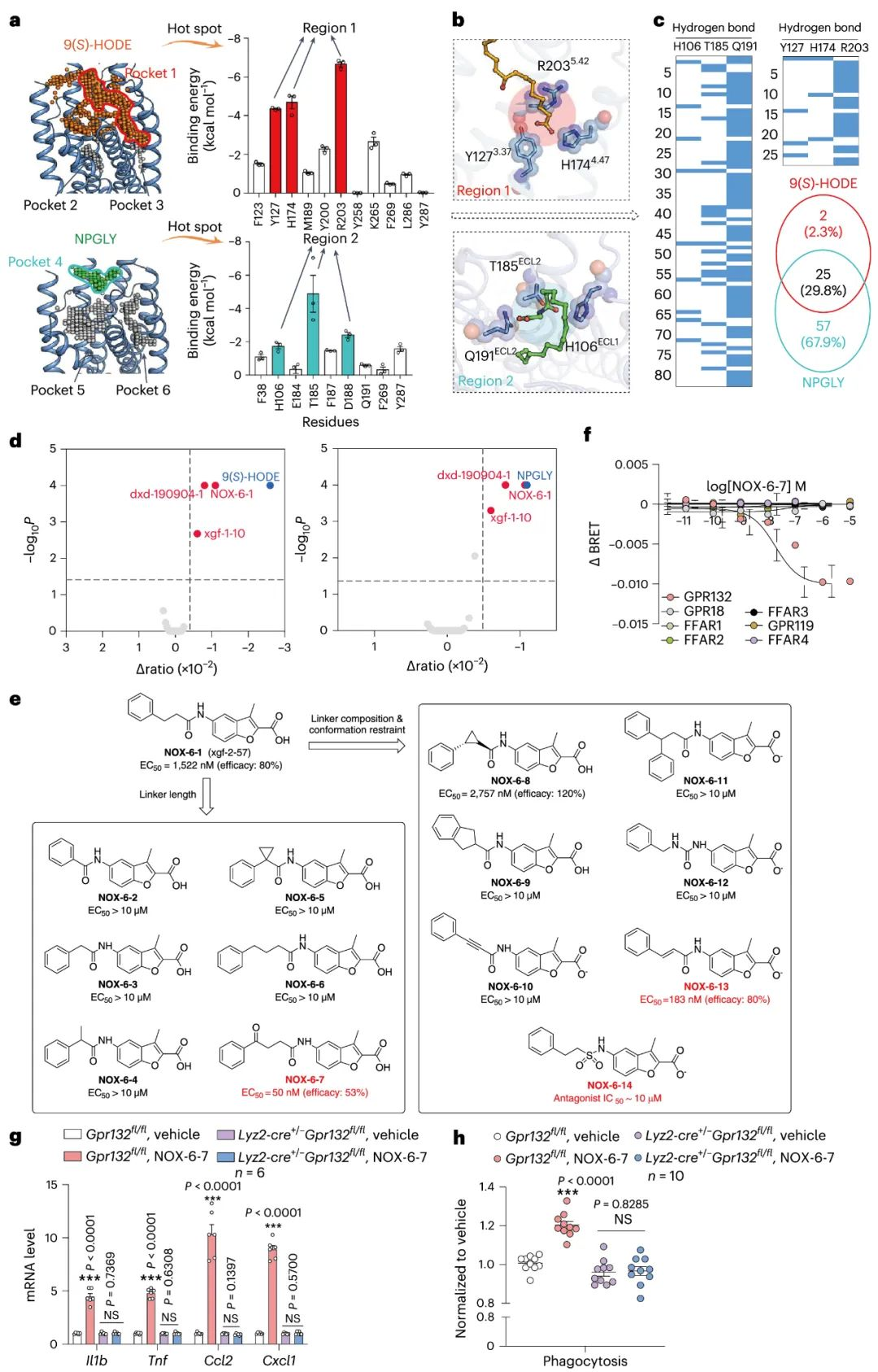
图5 基于Gi基础的GPR132激动剂开发
5.GPR132拮抗剂的筛选-NOX-6-18
此外,研究团队通过将弱激动剂NOX-6-1中酰胺连接改为磺酰胺连接,发现其不仅消除了Gi的活性,并拮抗了内源性配体激活Gi活性。研究团队采用分子动力学模拟, FlAsH-BRET和生化实验相结合的方法来评估化合物的结合位置, 发现了GPR132拮抗剂与激动剂之间转变的关键作用残基,最终找到了GPR132的强效选择性拮抗剂NOX-6-18(IC50约为14nM)。接下来,我们进行了计算模拟,以了解NOX-6-18如何与GPR132相互作用。在最终的模型中,插入口袋1中的NOX-6-18的羧酸头与GPR132的R2035.42发生电荷基相互作用。另外, NOX-6-18的4-氧-4-苯基丁胺与GPR132的TM3, ECL2, TM5-7的疏水残基以及与Y2586.51和K2656.58的氢键形成广泛的疏水接触。并且,研究结果表明NOX-6-18与GPR132中TM5-TM7特异性残基之间的相互作用是NOX-6-18对GPR132选择性的决定因素。
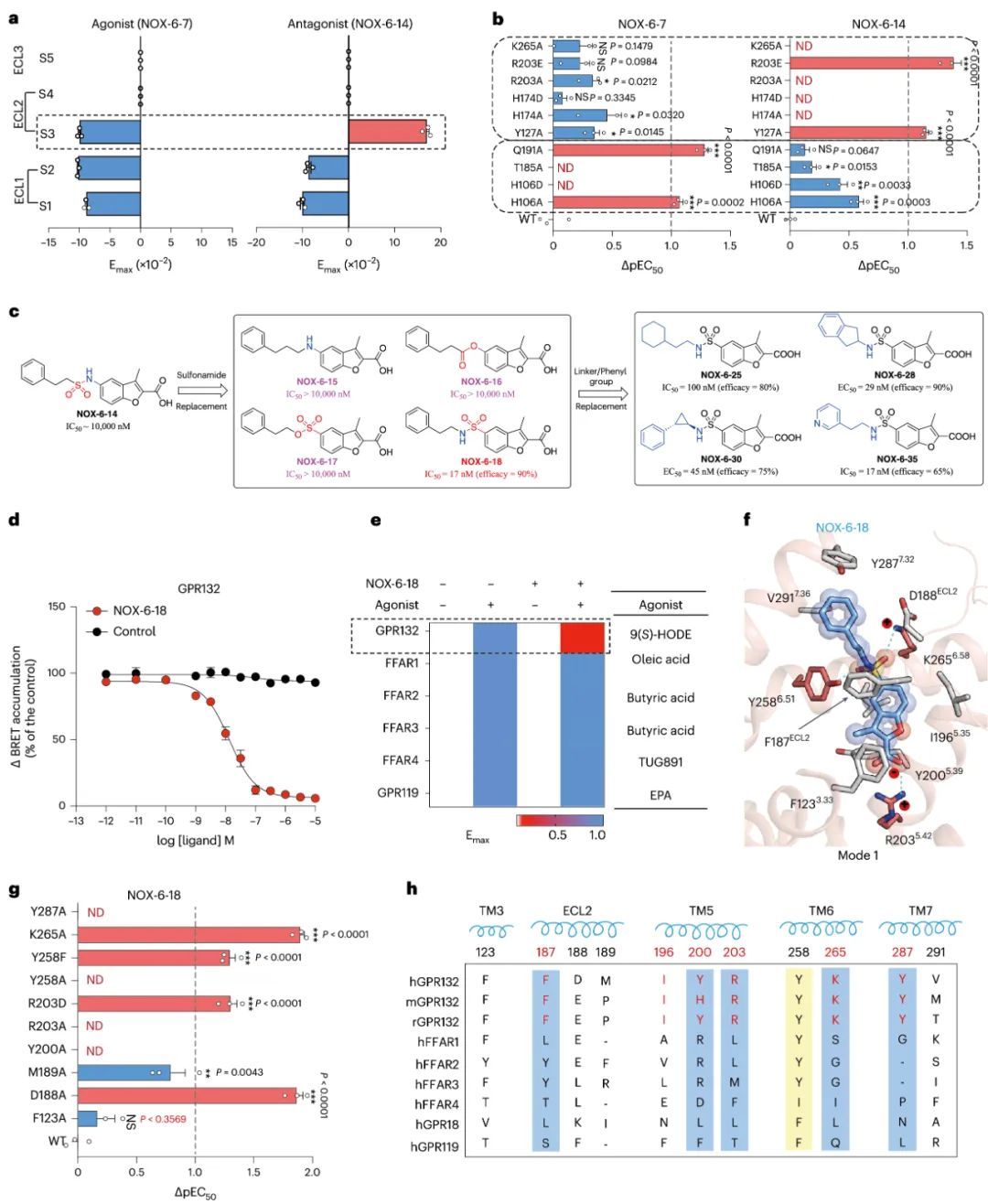
图6 选择性GPR132拮抗剂的研制
6.NOX-6-18对高脂饮食小鼠糖代谢的影响
接下来,为了确定合成的GPR132拮抗剂是否在体内产生有益的代谢作用。研究者在高脂饮食诱导的雄性和雌性小鼠中,给予NOX-6-18治疗12-14周,发现NOX-6-18能够改善高脂饮食引起的体重增加, 此外,高脂饮食小鼠的葡萄糖耐量和胰岛素耐量得到显著改善。另外, 在NOX-6-18治疗4-6周后, NOX-6-18显著降低了胰岛, 肝脏和脂肪组织的炎症水平,并且减少了胰岛组织中的巨噬细胞数量, 进而改善了代谢紊乱。这些结果表明,在饲喂高脂饮食的小鼠中,给予拮抗剂NOX-6-18能够显著增强胰岛巨噬细胞的葡萄糖代谢,并以GPR132依赖的方式降低其增殖速率和重编程程度。
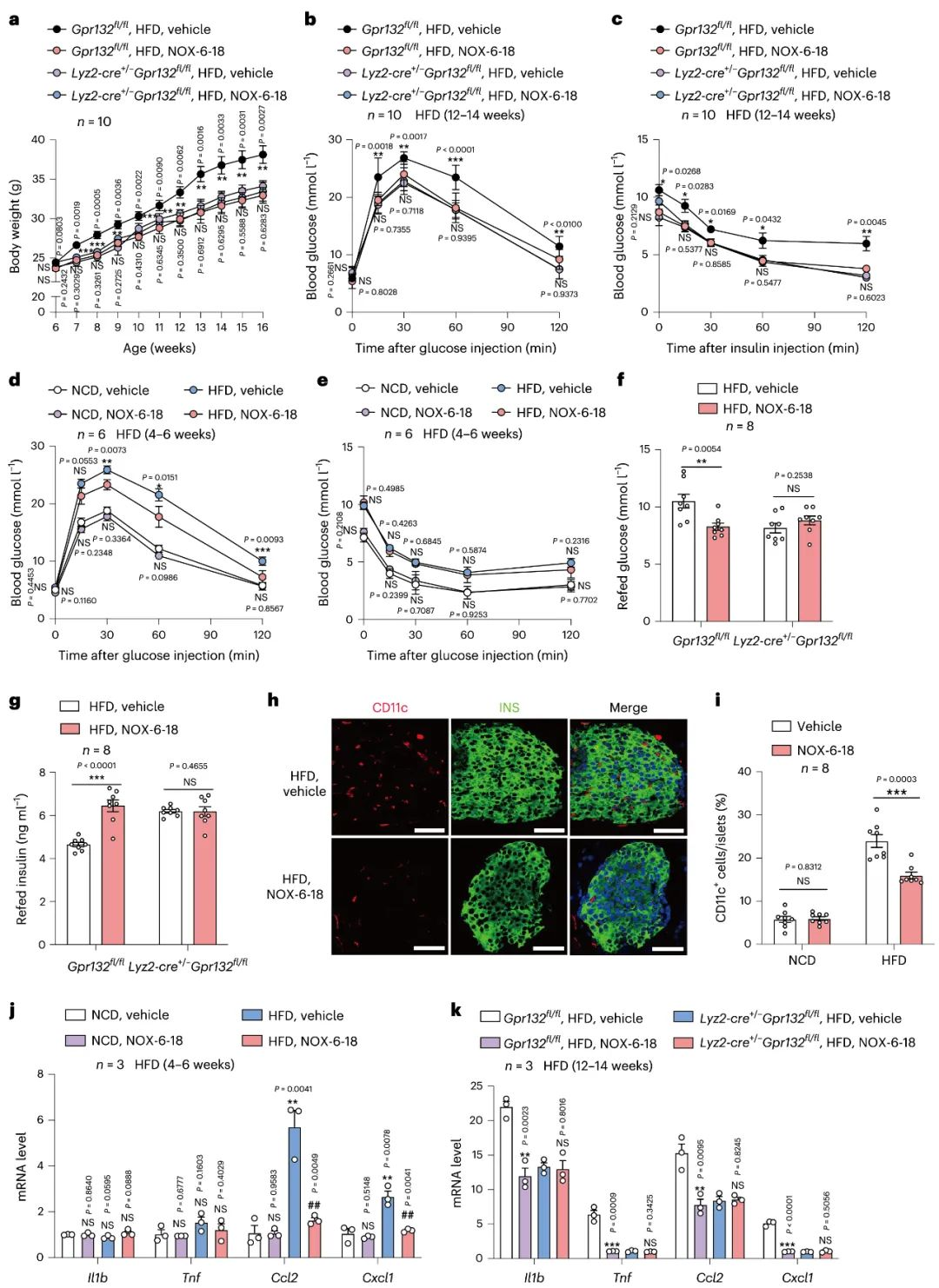
图7 GPR132拮抗剂改善高脂饮食喂养小鼠的葡萄糖代谢
文章结论与展望
总的来说, 作者通过代谢组学结合分子学实验, 发现了9(S)-HODE的水平以及GPR132的表达水平与糖尿病呈正相关, 通过反向验证 (基因敲除), 发现GPR132在内源性脂质刺激或高脂饮食压力下会发生巨噬细胞重编程。另外通过冷冻电镜, 分子动力学模拟, FlAsH-BRET以及化合物筛选发现了GPR132拮抗剂与激动剂之间转变的关键作用残基,最终找到了GPR132的强效选择性拮抗剂NOX-6-18(IC50约为14nM), 其在改善糖尿病的进程中发挥了显著的作用, 为糖尿病的临床治疗提供了一个可靠的治疗途径。
和元助力
和元生物有幸提供实验中使用的病毒包装 (AAV-cx3cr1-cre-eGFP、pADV-mCMV-DIO-pertussis toxin subunit 1 (TOX1)-P2A-EGFP) 服务
如您有相关业务需求,请联系和元生物客服(微信/电话):15800353038
原文链接: https://www.nature.com/articles/s42255-023-00899-4

扫一扫,反馈当前页面
和元生物