
【Nature Neuroscience】“快乐分子”多巴胺帮你规避危险信号
随着科普活动的开展,“多巴胺”这个名词早已不是大家闻所未闻的生僻词汇。多巴胺是一种神经传导物质,与人的情绪、感觉密切相关。它传递兴奋和开心的信息,因此多巴胺与各种成瘾行为均有关联。
在脑中,多巴胺由中脑多巴胺能神经元分泌,这些神经元主要分布于腹侧被盖区和黑质。大量研究表明多数多巴胺能神经元被奖赏性刺激激活,也被厌恶性刺激抑制[1]。
然而,一些多巴胺神经元可被非奖赏性刺激激活,如黑质致密区中的部分多巴胺神经元可同时被兴奋性、厌恶性刺激激活[2],那么这些多巴胺能神经元的功能是如何呢?

最近,大量研究借助神经元示踪、光纤钙成像技术,发现纹状体的不同亚区接收不同的多巴胺信号:投射到腹侧纹状体(VS)的多巴胺能神经元被奖赏刺激激活,而投射到尾端纹状体(TS)的多巴胺能神经元被中性、厌恶性刺激激活[3],研究这些神经元的生理功能对于理解多巴胺能神经元至关重要。
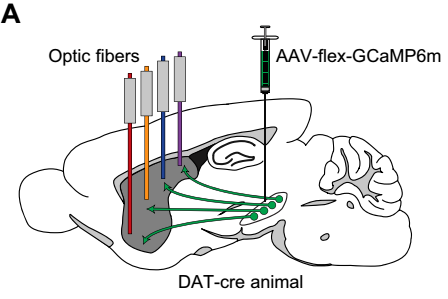
投射到纹状体各个亚区的多巴胺神经元[3]
2018年9月3日,《Nature Neuroscience》杂志在线刊登了哈佛大学N. Uchida研究组的最新重要工作,他们发现投射到尾端纹状体(TS)的多巴胺能神经元参与并调控外界厌恶性刺激的躲避行为,且与奖赏性行为无关。本篇文章首次解读了投射到TS多巴胺能神经元的功能机制,极大提高了人们对该领域的认知。

M. Watabe-Uchida教授(左一)、N. Uchida教授(右一)
1.多巴胺能神经元到TS的投射编码外界刺激强度
为研究多巴胺能神经元不同下游在不同行为中的神经活性变化,作者使用光纤钙成像方法,在DAT-Cre小鼠的腹侧被盖区(VTA)与黑质(SN)中注射AAV-DIO-GCaMP,并在VS或TS亚区埋植光纤。
实验结果发现,VS亚区的投射被水滴(奖赏性刺激)显著激活,而对声音刺激反应很小;相反,TS亚区的投射被声音刺激显著激活,而对奖励性的水滴无反应(图1a-b)。由于声音刺激一定程度上是一种厌恶刺激,于是作者接下来尝试多种厌恶性刺激,发现TS的投射对苦味饮水或预期水滴撤回无反应,而是被视、听、嗅、触等强烈外部刺激激活;与此不同,VS的投射被每种厌恶性刺激抑制(图1e)。
这些结果提示,TS的多巴胺投射不参与喜恶刺激,而是参与外界感觉刺激的反应。
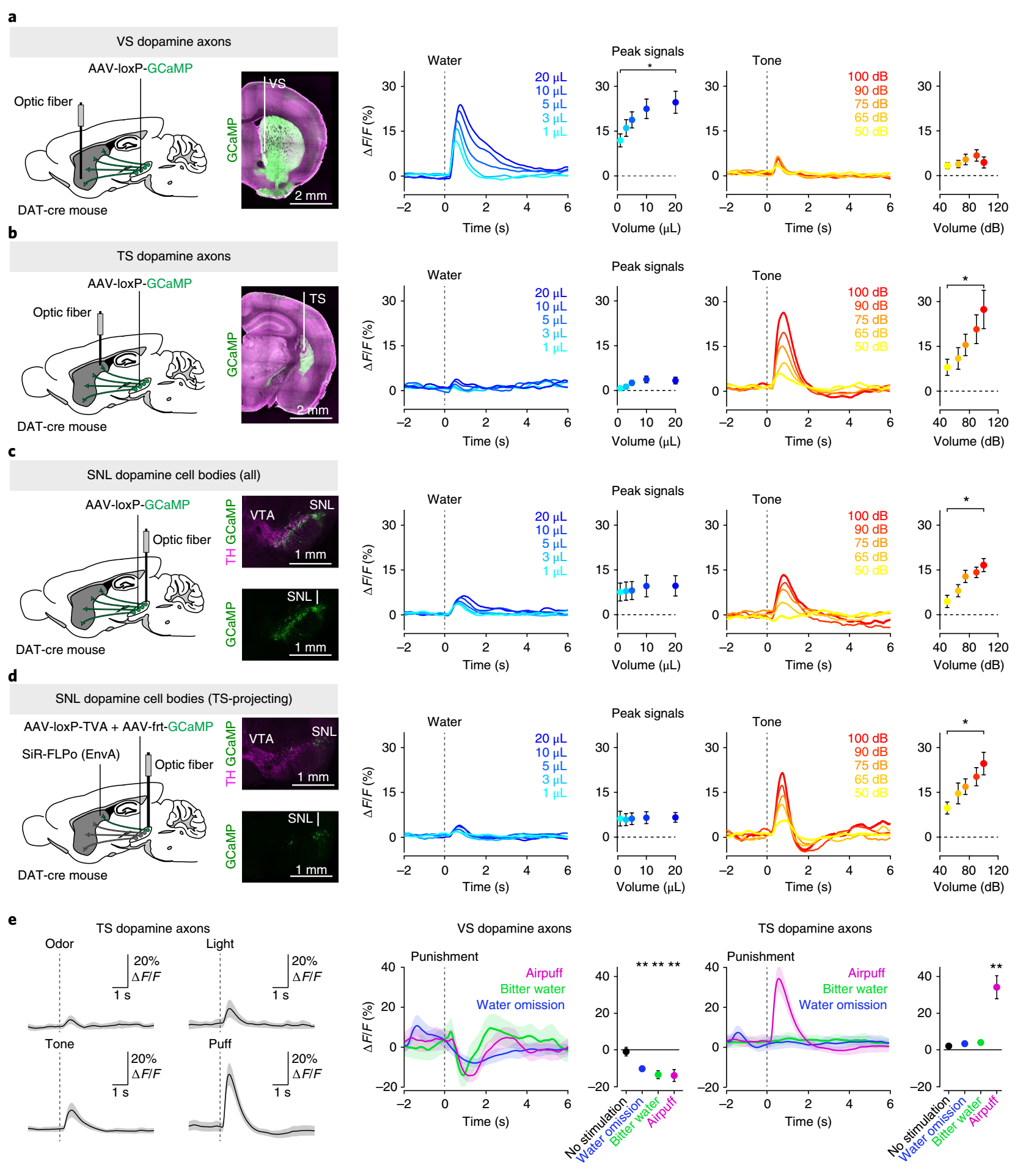
图1 多巴胺能神经元到TS的投射编码外界刺激强度而非效价估量
接下来,作者对发出投射的多巴胺能神经元胞体展开研究。作者使用狂犬病毒逆行示踪方法,发现投射到TS的多巴胺能神经元集中于黑质侧部,而且这些神经元不投射到其它脑区(图2)。然后作者重复上文光纤钙成像方法,在SNL记录投射到TS的多巴胺能神经元胞体,发现与TS投射的现象相似,SNL被声音激活而对奖赏性水滴无反应(图1c-d)。
综上,SNL-TS多巴胺能神经元环路不参与奖赏或厌恶的效价估量,而是参与外界刺激强度的编码。
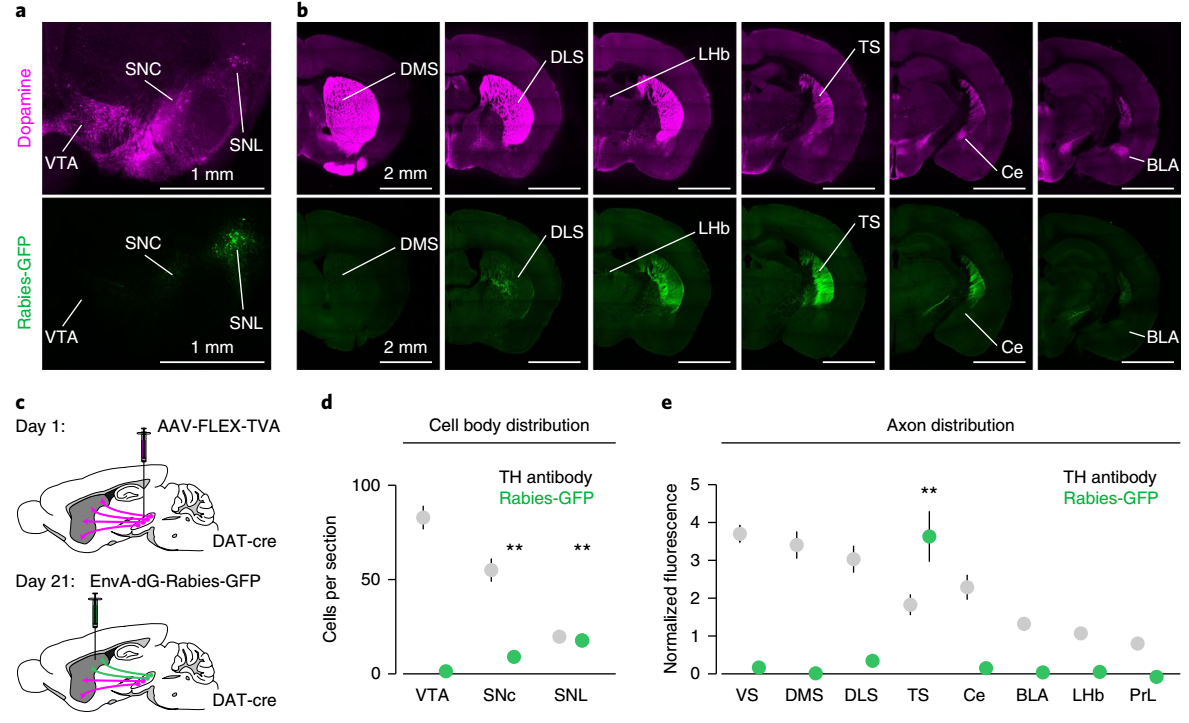
图2 投射到TS的多巴胺能神经元位于SNL且不投射到其它脑区
2.激活多巴胺能神经元到TS的投射诱发躲避行为
科学界普遍认为,多巴胺能神经元的激活是一种正反馈增强。换句话说,多巴胺的释放增加了机体做出提高多巴胺释放水平的行为或决策[4, 5]。然而前文的结果表明投射到TS的多巴胺能神经元很可能有其他功能,作者就此展开研究。
他们在DAT-Cre小鼠的中脑注射AAV-DIO-ChR2,在VS或TS埋植光纤(图3a)。他们建立一种行为学范式,小鼠在接收信号后会在两侧选择水源,其中一侧正常提供,另一侧在供水的同时附带条件,如加量供水、吹气、掺苦味剂等等(图3b)。与正常供水侧相比,小鼠倾向于加量供水一侧,而避开吹气、苦水一侧(图3c)。当附加条件为LED蓝光激活时,作者发现小鼠倾向于光激活VS投射一侧,而避开光激活TS投射一侧(图3d),表明多巴胺能神经元到TS的投射调控躲避行为,而非正反馈增强。
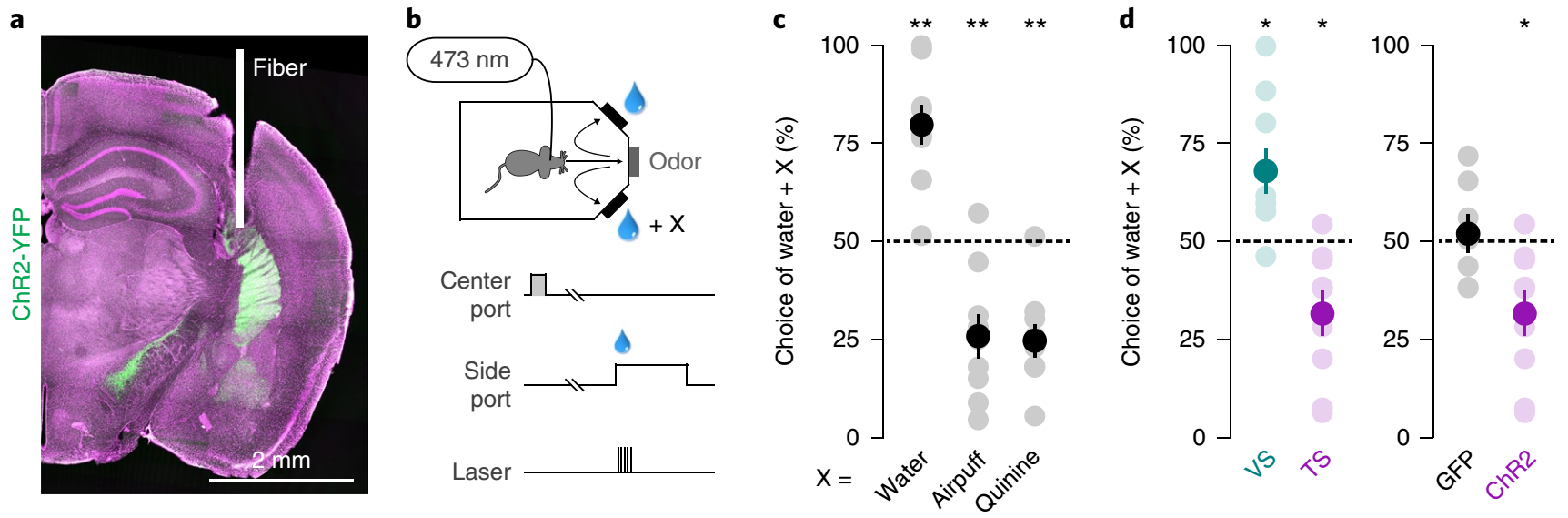
图3 激活多巴胺能神经元到TS的投射诱发躲避行为
3.损毁多巴胺能神经元到TS的投射减少威胁性刺激躲避行为
接下来,作者研究损毁TS投射对小鼠带来的影响。他们在TS埋管注入神经毒素6-羟基多巴胺(6-OHDA),从而杀死SNL的多巴胺能神经元胞体(图4a)。作者继续使用上文行为学范式(图4b),发现杀死投射到TS的多巴胺神经元后,小鼠仍然躲避苦水与少量供水一侧,但是不再躲避吹气一侧(图4c-d)。然后,他们在TS注射多巴胺1型受体拮抗剂,重复了上述现象(图4e-f)。这些结果表明多巴胺能神经元到TS的投射在躲避威胁性刺激行为过程中具有必要性,而且此功能通过多巴胺1型受体调控。
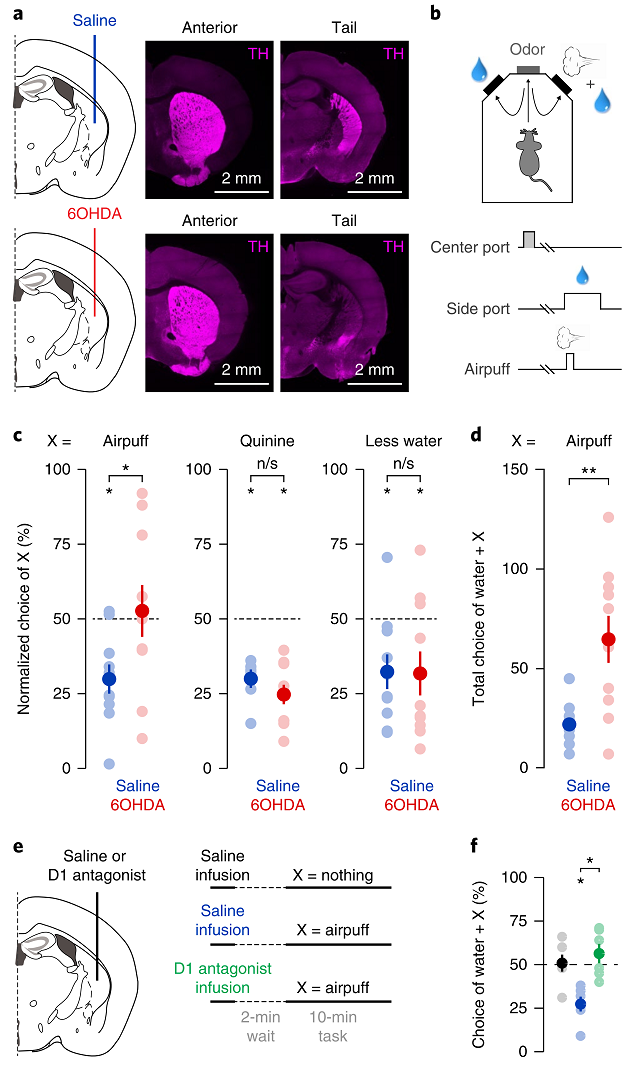
图4 损毁多巴胺能神经元到TS的投射减少威胁性刺激躲避行为
4.损毁多巴胺能神经元到TS的投射不影响初次躲避行为
在上文行为中,作者还发现了一个意外的现象。在供水侧附加吹气初始阶段,杀死TS投射的小鼠与对照组小鼠均会产生躲避行为。然而随着实验次数的提升,对照组小鼠维持着躲避现象,但杀死TS投射的小鼠不再躲避这一侧(图5a-c)。光纤钙成像结果显示,面对吹气刺激,无论第一次还是后续实验,多巴胺能神经元到TS的投射均被激活(图5d-f)。
上述结果表明,存在神经系统负责调控初次面对外界威胁性刺激的反应[6],而投射到TS的多巴胺系统负责躲避行为的维持。
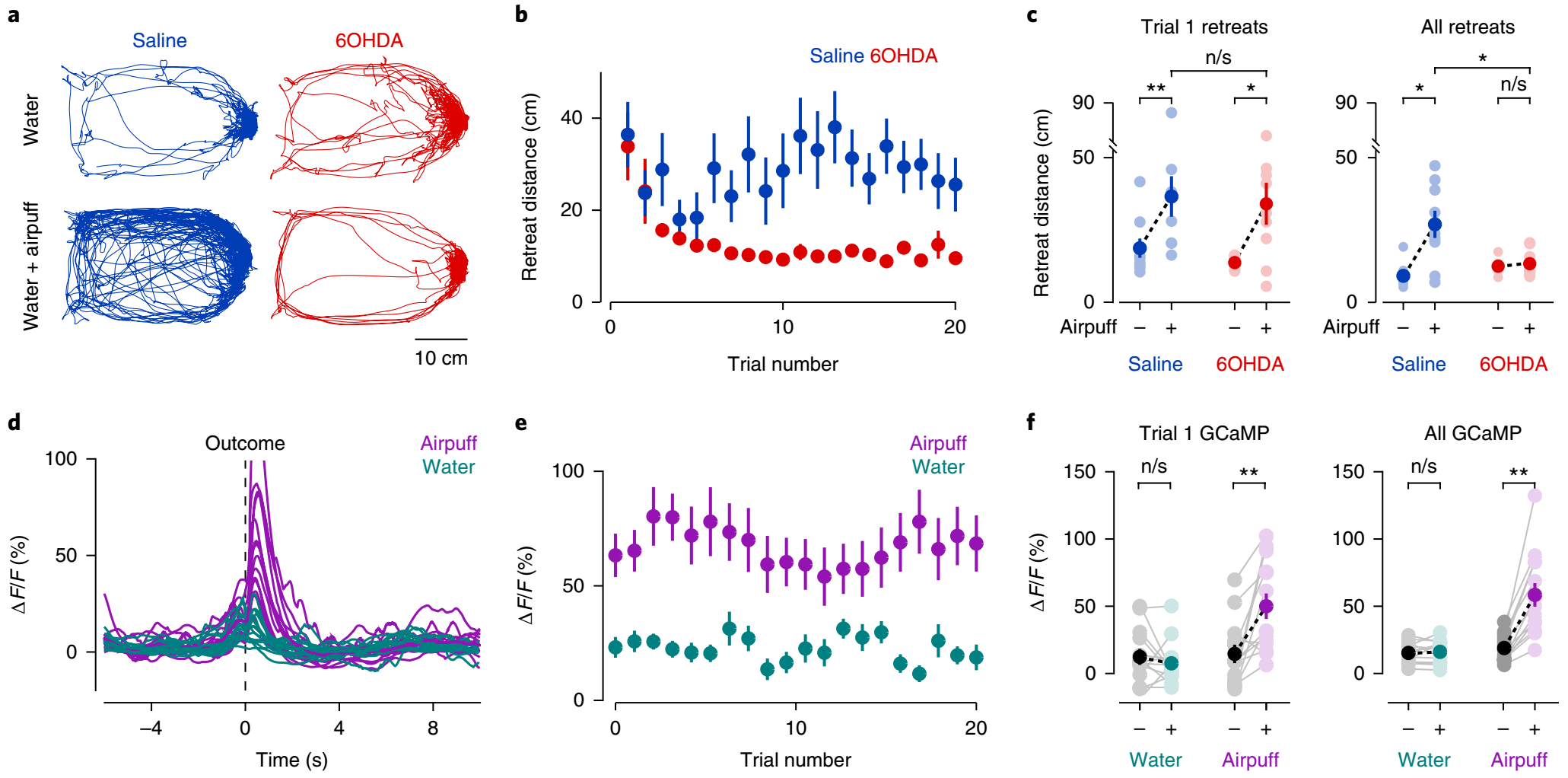
图5 损毁多巴胺能神经元到TS的投射不影响初次躲避行为
5.多巴胺能神经元到TS的投射强化巩固小鼠对新事物的躲避行为
上文结果显示多巴胺能神经元到TS的投射参与并调控威胁性刺激的躲避行为,然而吹气、声音等刺激不仅仅是威胁性刺激,也属于新奇事物范畴。在新奇事物探索这一方面,作者展开如下研究。
他们首先建立了新奇事物探索行为学范式,发现小鼠发现新物体时,会先去接近它,然后迅速撤退,如此反复;而熟悉的物体不会诱发此种现象(图6a)。TS亚区的光纤钙成像结果显示,在小鼠刚刚作出撤退行为时,多巴胺能神经元TS投射被激活,而在接触、探索时无反应;同样地,熟悉的物体不会诱发此现象(图6b-c)。
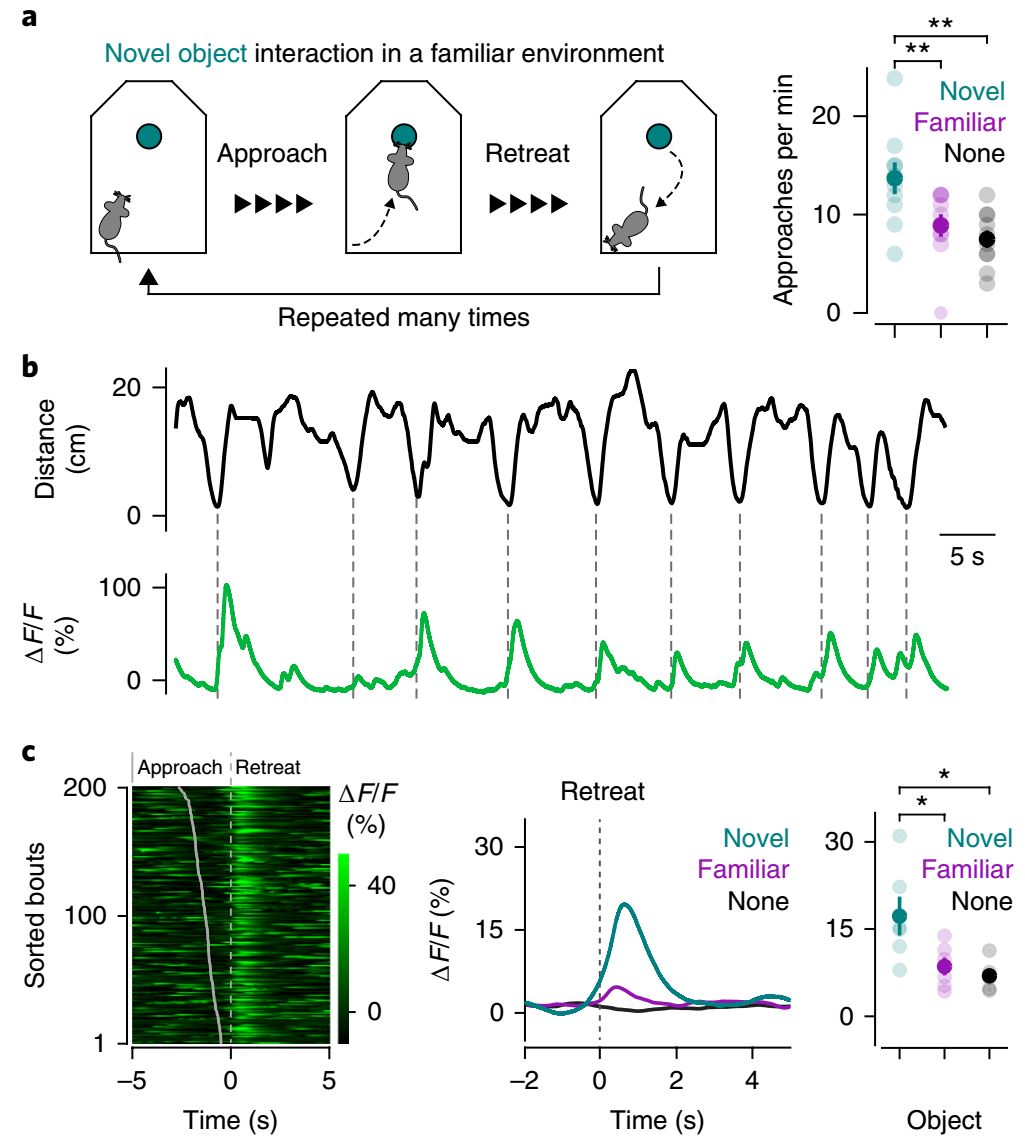
图6 多巴胺能神经元到TS的投射在小鼠撤退时而非探索新奇事物时被激活
最后,为研究多巴胺能神经元到TS投射在新奇事物探索方面的调控,他们通过6-OHDA杀死或通过ChR2光激活TS投射,发现杀死多巴胺系统TS投射不影响新奇事物初次探索的躲避,而显著减少后续实验的躲避行为(图7a-b);与之相反,光激活多巴胺系统TS投射增加小鼠对新奇事物的躲避行为(图7c)。
综上,多巴胺能神经元到TS的投射参与并调控对新奇事物躲避行为的强化过程,对此功能具有充要性。
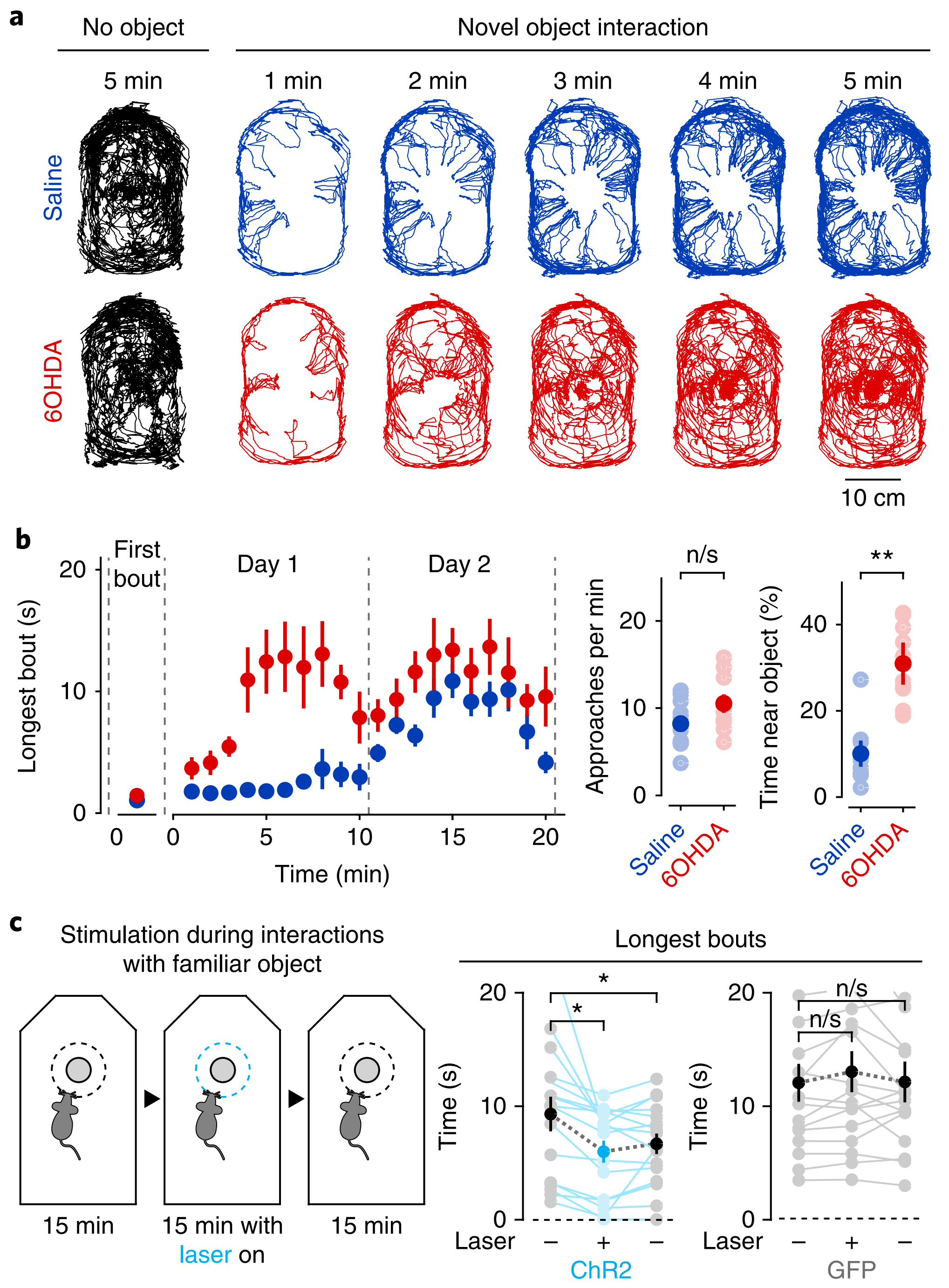
图7 损毁多巴胺能神经元到TS的投射减少新事物躲避行为,激活此环路增加躲避行为
多巴胺是一种神经传导物质,与人的多种情绪、感觉息息相关。投射到腹侧纹状体(VS)的多巴胺能神经元被奖赏刺激激活,指引我们寻找快乐。而对于投射到尾端纹状体(TS)的多巴胺能神经元的功能,我们尚未可知。本篇文章结合光遗传、神经示踪、行为学等方法,首次发现多巴胺能神经元到TS的投射参与威胁性刺激的躲避行为,而与奖赏性刺激无关。激活此投射诱发躲避行为,而损毁这一投射减少躲避行为。这项研究极大提高了我们在多巴胺系统功能领域的认知,揭示了多巴胺系统的两条并行环路(图8),让我们了解到多巴胺系统不仅是照亮宝藏的灯塔,更是规避危险的警钟!
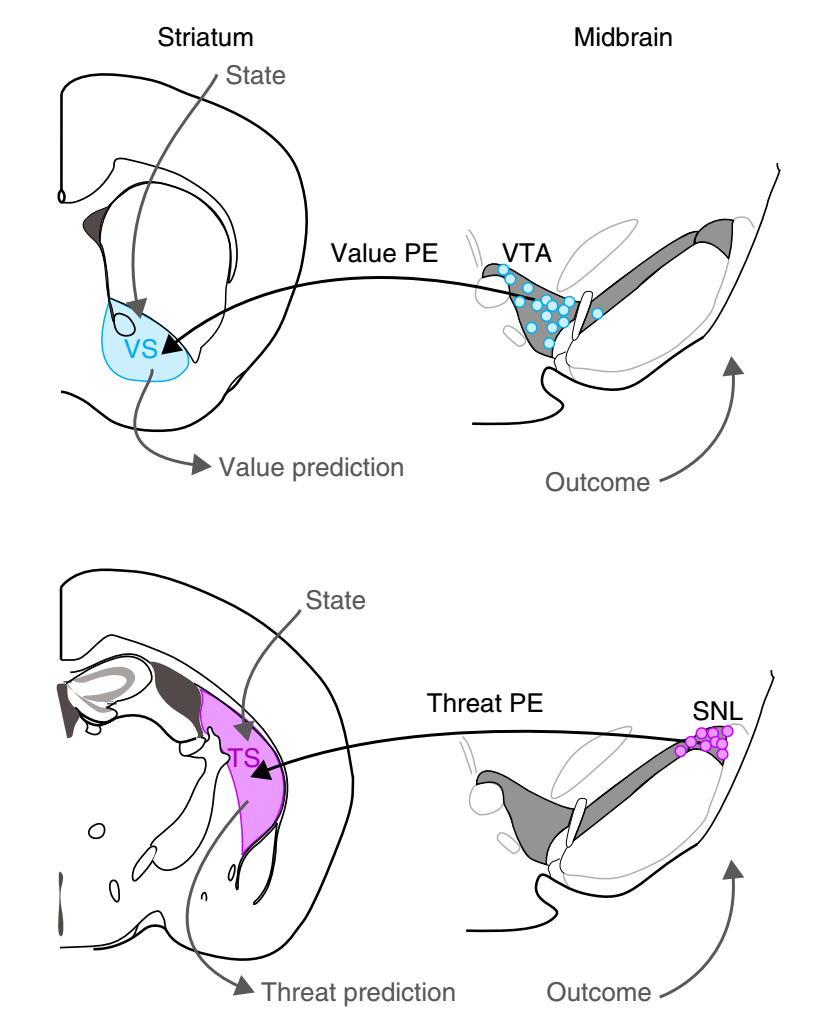
图8 多巴胺系统的两条并行环路
和元生物 一直关注神经、代谢、肿瘤科学领域的重大研究进展,为神经生理、病理研究提供最新工具和研究方案,助力临床转化和基因治疗!
参考文献
1.Matsumoto, H., et al., Midbrain dopamine neurons signal aversion in a reward-context-dependent manner. Elife, 2016. 5.
2.Matsumoto, M. and O. Hikosaka, Two types of dopamine neuron distinctly convey positive and negative motivational signals. Nature, 2009. 459(7248): p. 837-U4.
3.Menegas, W., et al., Opposite initialization to novel cues in dopamine signaling in ventral and posterior striatum in mice. Elife, 2017. 6.
4.Schultz, W., P. Dayan, and P.R. Montague, A neural substrate of prediction and reward. Science, 1997. 275(5306): p. 1593-9.
5.Bayer, H.M. and P.W. Glimcher, Midbrain dopamine neurons encode a quantitative reward prediction error signal. Neuron, 2005. 47(1): p. 129-41.
6.LeDoux, J. and N.D. Daw, Surviving threats: neural circuit and computational implications of a new taxonomy of defensive behaviour. Nat Rev Neurosci, 2018. 19(5): p. 269-282.

扫一扫,反馈当前页面
和元生物