
【快讯】MustangBio慢病毒基因治疗X-SCID产品MB107获得欧盟EMA先进治疗药物认证

2020年4月20日最新消息,美国生物医药公司Mustang Bio宣布,欧盟药品管理局(EMA)已经授予其MB-107产品的先进治疗药品(Advanced Therapy Medicinal Product, A TMP)分类认证。

MB-107是Mustang旗下的一款基于慢病毒的基因疗法,用于治疗x染色体连锁的重度联合免疫缺陷症(X-SCID),也被称为“气泡男孩症”。此前,2019年8月,MB-107已获得美国食品和药物管理局(FDA)对其的再生医学先进治疗疗法(“RMAT”)认证。

根据欧盟规定,EMA将ATMP分类一般授予基于基因或细胞的新疗法,这些疗法旨在从遗传、细胞或组织水平上对急性或慢性人类疾病提供长期或永久的治疗方案。ATMP项目为ATMPs产品的临床前开发、生产和产品质量检测提供具体的监管指南,并提供激励措施,包括降低监管意见、建议、质量评估和认证、非临床实验的费用等。

Mustang Bio总裁兼首席执行官Manuel Litchman博士表示,EMA授予MB-107以ATMP认证,是Mustang Bio在欧洲建立市场认可和商业化道路上迈出的重要一步,欧盟给予的ATMP分类补充了2019年Mustang从FDA获得的RMAT认证,使他们离实现X-SCID新型疗法MB-107的商业化目标更近了一步,这也为患者带来了迫切需要的创新治疗方案。

目前,MB-107正在接受针对X-SCID的两个I/II期临床试验评估。第一个临床试验委托St. Jude Children’s Research Hospital (“St. Jude”)、加州大学旧金山分校Benioff Children’s Hospital和西雅图儿童医院进行中,主要针对新诊断的两岁以下X-SCID患儿开展。

第二个临床试验主要依托美国国家卫生研究院(National Institutes of Health)开展,主要针对接受过造血干细胞移植的两岁以上X-SCID患者。根据与St. Jude的授权合作关系,Mustang Bio将开发慢病毒基因治疗疗法,并致力于将MB-107用于商业用途,造福X-SCID患者。
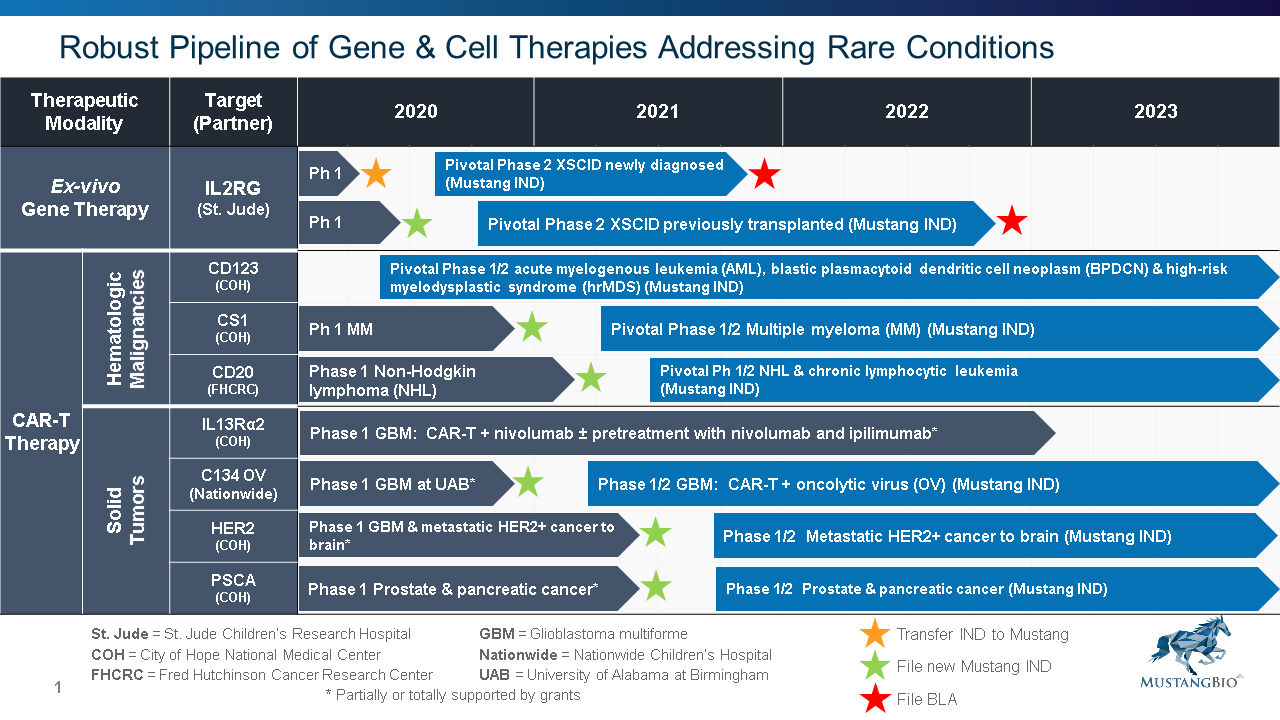
Mustang Bio是一家临床级生物制药公司,是Fortress Biotech的子公司。专注于将细胞和基因治疗方面的医学突破转化为临床应用疗法,他们重点关注血液肿瘤、实体肿瘤和罕见基因疾病的潜在方法。Mustang布局多个产品线,他们不断尝试通过授权或以其他方式获得所有权权益来获得上述细胞和基因治疗技术,为研究和开发提供资金,并通过授权或将这些技术推向市场。目前,Mustang已经与多家国际顶级医疗机构合作,推进CAR-T疗法在多种癌症中的应用,以及X-SCID的慢病毒基因疗法。

重度联合免疫缺陷病(SCID),又被称为“气泡男孩症”。最常见的发病机制为X染色体上基因中的突变(因而被称作X连锁疾病),并且几乎全出现在男孩中。这种罕见的先天遗传病患者,免疫系统细胞不能正常发育,甚至是父母的一次接触,亦或是普通的感冒都可能是致命性的,因此不得不严格隔离以防感染。这种遗传疾病由IL2RG基因的突变引起,该基因对免疫系统需要正常工作的蛋白质进行编码,因此该病的特点是缺乏关键免疫细胞的功能,导致严重损害免疫系统。
基因治疗X-SCID则是该疾病治疗的新希望。2019年4月17日,Mustang Bio在新英格兰医学杂志(NEJM)发表了MB-107用于2岁以下X-SCID患儿的临床I/II期阳性数据,报道这项新型基因疗法已经一定程度治愈了八名重症联合免疫缺陷(X-SCID)患儿。
以“基因药·中国造”为使命,助力基因治疗造福人类的伟大愿景。


扫一扫,反馈当前页面
和元生物