
基因治疗+光遗传治疗视网膜色素变性-GenSight发布关于GS030临床III期试验的积极安全性数据

2020年4月15日,GenSight Biologics公司发布其最新基于光遗传学和基因治疗的GS030疗法PIONEER临床试验I/II期进展,他们宣布,独立的数据安全监察委员会(Data Safety Monitoring Board , DSMB)已完成对上述临床试验的第二次安全审查。GS030是Gensight开发的结合基因治疗、光遗传学技术治疗视网膜色素变性(RP)的一款新型疗法。

DSMB确认,第二组三名受试者中没有发现任何疗法相关的安全方面问题。改组测试中,受试者每人接受单次1.5*10^11 vg总量的玻璃体内病毒注射,注射后使用可穿戴式光电视觉刺激装置。对此,DSMB给出进一步建议,GenSight可在不修改方案的情况下按原计划继续进行后续临床试验,并可以启动招募第三组3名受试者(最大病毒使用剂量5*10^11 vg)。

对此,GenSight首席医学官Magali Taiel博士表示,根据DSMB的结论,GenSight很高兴能够继续推进GS030项目,截至目前GS030已经治疗了6名患者。后续,他们非常期待看到GS030在最高剂量下的安全性,并试图通过在晚期RP患者中显示功能视力恢复的表型来证明GS030在治疗RP中的有效性。

值得一提的是,近来全球大流行的COVID-19对该临床试验也造成了困扰。在GS030疗法中,GenSight在基因治疗前和基因治疗后会选择皮质类固醇注射,以便预防和减少炎症反应,但这一做法可能使受试者面临更高的COVID-19感染风险。因此,为了保护目前COVID-19情况下受试者的安全,结合RP慢性疾病的特点,GenSight和调研人员共同决定,在公共卫生状况未改善之前,推迟招募新受试患者进入第三临床试验队列。在此期间,前两组接受GS030治疗的6名患者正在接受调查人员的远程安全监控。按原定计划,GenSight预计在2020年下半年完成受试者招募,在COVID-19的情况下,GenSight正在尽快评估这一点。

GS030是基于GenSight技术开发的一种新型光遗传学技术平台,该平台利用基因治疗手段,借助单次玻璃体内注射,将携带光敏蛋白基因的病毒注射到视网膜,并感染视网膜神经节细胞,表达光敏蛋白使其对光产生反应,从而获得对光的感受。GS030将单次玻璃体内注射的基因治疗(GS030- dp)与可穿戴式光电视觉刺激装置(GS030- md)相结合。目前,GS030在美国和欧洲被授予孤儿药称号。
PIONEER是一项首次在人、多中心、开放标签、剂量递增的临床试验研究,旨在评估18例视网膜色素变性患者对于GS030疗法的使用安全性和耐受性。在该试验中,主要的结果分析是注射后一年的安全性和耐受性,该试验在英国、法国和美国的三个中心进行。

GenSight Biologics是一家临床级生物制药公司,专注于发现和开发视网膜神经退行性疾病和中枢神经系统疾病的创新基因疗法。GenSight Biologics的产品线依托两个核心技术平台,分别是线粒体靶向序列(MTS)和光遗传学技术平台,在该技术的帮助下,GenSight正帮助患有致盲性视网膜疾病的患者保持或恢复视力。
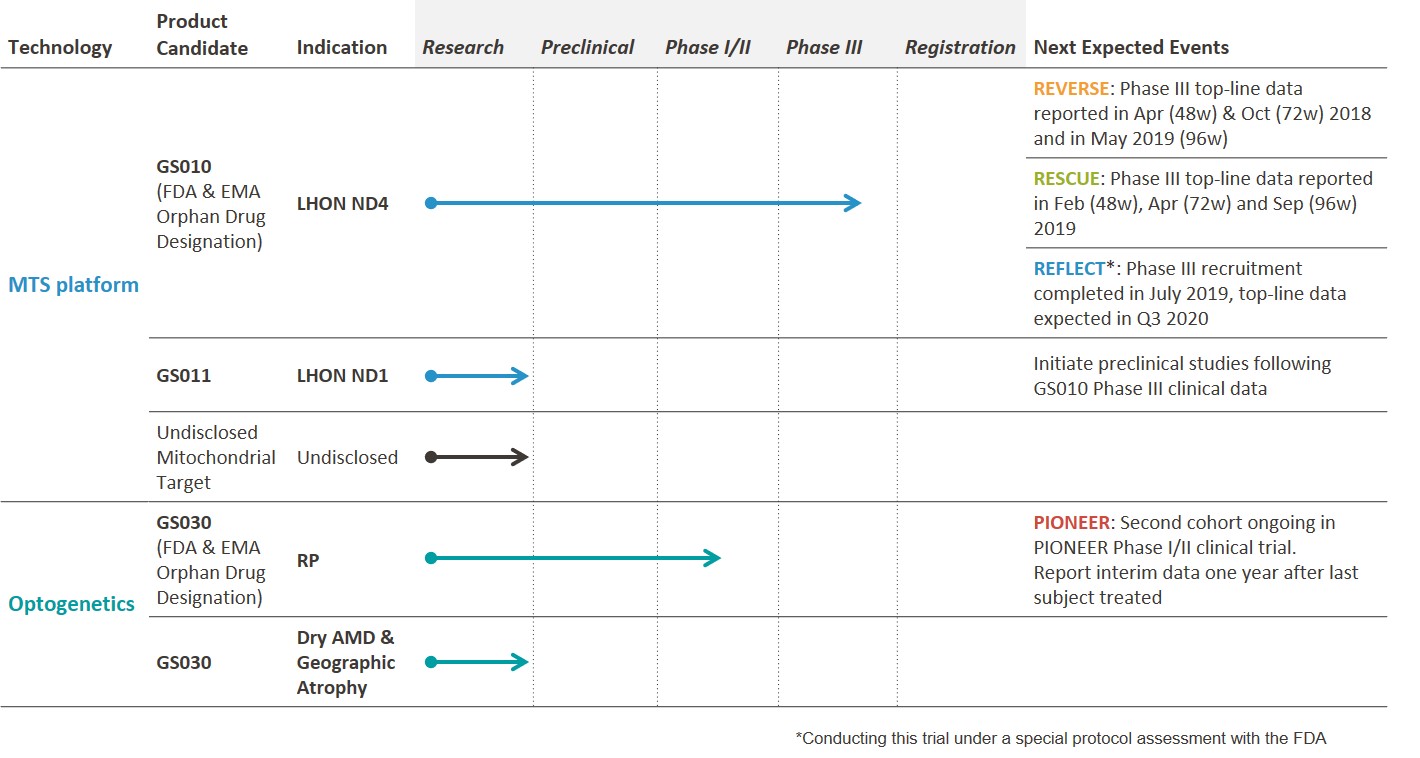
GenSight Biologics的候选产品主要采用基于基因治疗的方法,通过玻璃体内注射,对每只眼睛进行单次治疗,为患者提供可持续的视觉功能恢复。GenSight Biologics的主要候选产品LUMEVOQ®(GS010)正在进行Leber遗传性视神经病变(LHON)的III期临床试验,Leber是一种罕见的线粒体疾病,会导致青少年和年轻人不可逆失明。

光遗传学(Optogenetics)是结合了光学(Optics)及遗传学(Genetics)的技术,借助其,我们能在活体动物甚至是自由运动的动物脑、脊髓、外周神经内,精准地控制特定种类神经元的活动。光遗传学在时间上的精确度可达到毫秒级别,在空间上的精确度则能达到单个细胞甚至细胞器级别,是一项重要的实用性技术。

过去,针对该技术的应用主要在实验动物上使用,近来已经有包括华人科学家潘卓华(Retrosense公司)在内的大量科学家和公司将光遗传学技术应用于临床治疗视网膜疾病。
作为一家新型基因和细胞治疗产业化CDMO服务公司,和元生物 可提供非注册临床研究用质粒和病毒生产、基因治疗新药临床申报整体方案、基因治疗临床样品及商业化GMP生产等服务,涉及产品包括基因和细胞治疗用质粒、慢病毒、腺相关病毒、溶瘤病毒、新型基因疫苗等,同时欢迎基于外泌体的药物开发合作。
以“基因药·中国造”为使命,助力基因治疗造福人类的伟大愿景。


扫一扫,反馈当前页面
和元生物