DNA转录成mRNA要再翻译成具有特定氨基酸序列的蛋白质才能在体内发挥功能,其中大部分蛋白质往往还需要经过化学修饰才能具备真正的活性,这种修饰称为蛋白质翻译后修饰 (Protein translational modifications,PTMs)。翻译修饰的过程,就是在蛋白质氨基酸序列中添加特定氨基酸或改变特定化学官能团的过程,进而改变蛋白质的结构。已有实验证明有三百多种潜在的PTM类型,并且同一个蛋白质可能在多个位点发生修饰,这就促成了蛋白结构和功能上的多样性。
PTMs通过功能基团或蛋白质的共价添加、调节亚基的蛋白水解切割或整个蛋白质的降解来增加蛋白质组功能多样性。这些修饰几乎影响正常细胞生物学和发病机制的所有方面。因此,识别和理解PTM在细胞生物学和疾病治疗和预防的研究中至关重要。
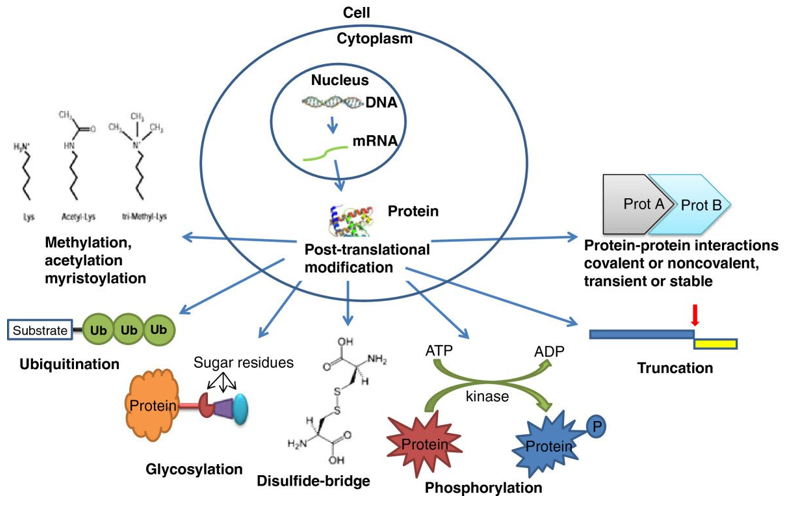
图1 PTM修饰类型
磷酸化蛋白组
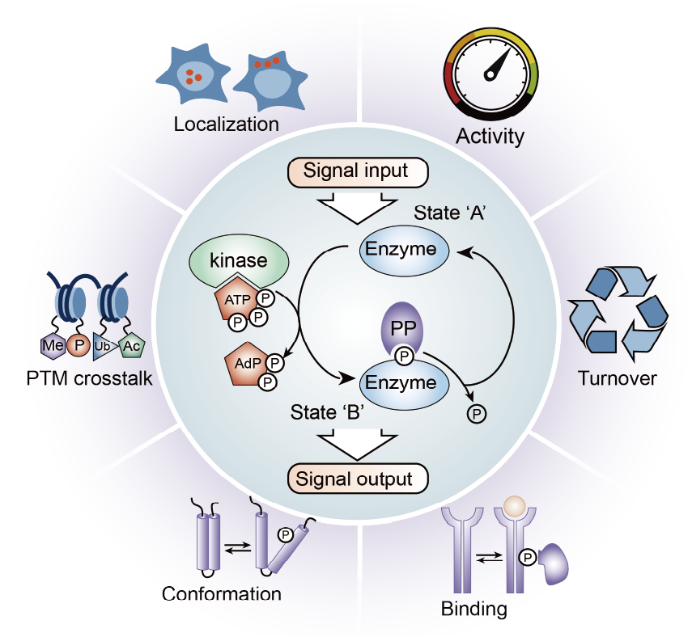
磷酸化蛋白组(Phosphoproteome) 指细胞、组织或生物体中所有被磷酸化修饰的蛋白质及其修饰位点的集合。磷酸化作为最常见的蛋白质翻译后修饰(PTM)之一,通过激酶催化磷酸基团连接到蛋白质的丝氨酸(Ser)、苏氨酸(Thr)或酪氨酸(Tyr)残基上,调控蛋白质的活性、定位、互作及降解,在细胞信号传导、代谢调控、细胞周期、分化和疾病发生中起核心作用。
图2 磷酸化蛋白的生物学功能
应用场景
1. 细胞信号通路解析
案例:在生长因子(如 EGF)刺激下,磷酸化蛋白组学可追踪 RTK-RAS-MAPK 通路中关键激酶(如 ERK1/2)的磷酸化动态,揭示信号传导的时空调控机制。
2. 疾病机制研究
癌症:磷酸化异常是肿瘤发生的标志,如乳腺癌中 HER2 受体酪氨酸磷酸化激活 PI3K-AKT 通路,驱动细胞增殖;磷酸化蛋白组学可鉴定肿瘤特异性磷酸化位点作为预后标志物。
神经退行性疾病:阿尔茨海默病中 tau 蛋白的过度磷酸化形成神经纤维缠结,通过磷酸化蛋白组学可定位关键修饰位点(如 Ser396),为药物开发提供靶点。
3. 药物研发与精准医疗
靶点验证:激酶抑制剂(如伊马替尼)的作用机制可通过磷酸化蛋白组学检测下游底物磷酸化水平的变化,评估药物疗效。
生物标志物发现:血液或体液中磷酸化蛋白的异常表达可作为疾病诊断标志物,如非小细胞肺癌患者血清中磷酸化 ALK 蛋白的水平与靶向治疗响应相关。
乙酰化蛋白组
乙酰化蛋白组(Acetylproteome) 指细胞、组织或生物体中所有被乙酰化修饰的蛋白质及其修饰位点的集合。乙酰化是通过乙酰基转移酶(如 HATs)将乙酰辅酶 A(Acetyl-CoA)的乙酰基(-COCH₃)转移至蛋白质的赖氨酸(Lys)残基上(少数情况下涉及丝氨酸、苏氨酸等),其反向调控由去乙酰化酶(如 HDACs)完成。
乙酰化修饰与蛋白活性调控紧密相关;大部分研究发现非组蛋白乙酰化发生在赖氨酸残基,这种修饰对于影响mRNA稳定,蛋白定位,相互作用以及降解过程扮演重要角色。更有趣的是,这些非组蛋白乙酰化与肿瘤发生,癌细胞增殖,免疫效应还有关。
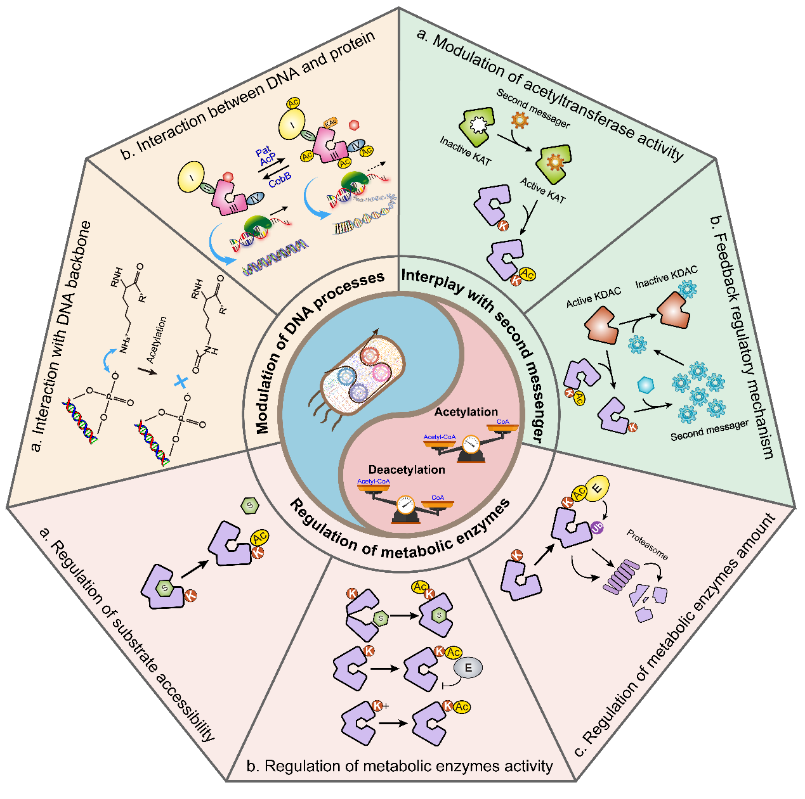
图3 乙酰化蛋白的生物学功能
应用场景
1. 表观遗传与基因调控
在肿瘤细胞中,组蛋白 H3K27 乙酰化水平降低与 Polycomb 复合体(PRC2)介导的基因沉默相关,而 HDAC 抑制剂(如伏立诺他)可恢复该修饰,重新激活抑癌基因表达。
2. 代谢疾病与能量稳态
肝脏代谢:乙酰化蛋白组学发现,丙酮酸脱氢酶(PDH)的赖氨酸乙酰化抑制其活性,导致糖酵解增强,这在非酒精性脂肪肝(NAFLD)中与线粒体功能异常密切相关。
糖尿病:胰岛素受体底物(IRS-1)的乙酰化可抑制胰岛素信号传导,促进胰岛素抵抗,提示乙酰化修饰可能成为 2 型糖尿病的治疗靶点。
3. 癌症机制与靶向治疗
白血病:MLL 融合蛋白通过异常乙酰化调控 HOX 基因表达,驱动白血病发生,其相关乙酰化位点(如 H3K4)已成为表观遗传药物开发的热点。
生物标志物:血清中乙酰化 α-1 - 抗胰蛋白酶(AAT)的水平可作为肝癌诊断标志物,其灵敏度优于传统标志物 AFP。
泛素化蛋白组
泛素化蛋白组(Ubiquitinome) 指细胞中所有被泛素(Ubiquitin, Ub)修饰的蛋白质及其修饰位点的集合。泛素化是一种高度动态的翻译后修饰,通过三步酶促反应(E1-E2-E3)将泛素分子(76 个氨基酸,8.5kDa)连接到靶蛋白的赖氨酸(Lys)残基 ε- 氨基上(少数情况涉及丝氨酸、半胱氨酸等)。
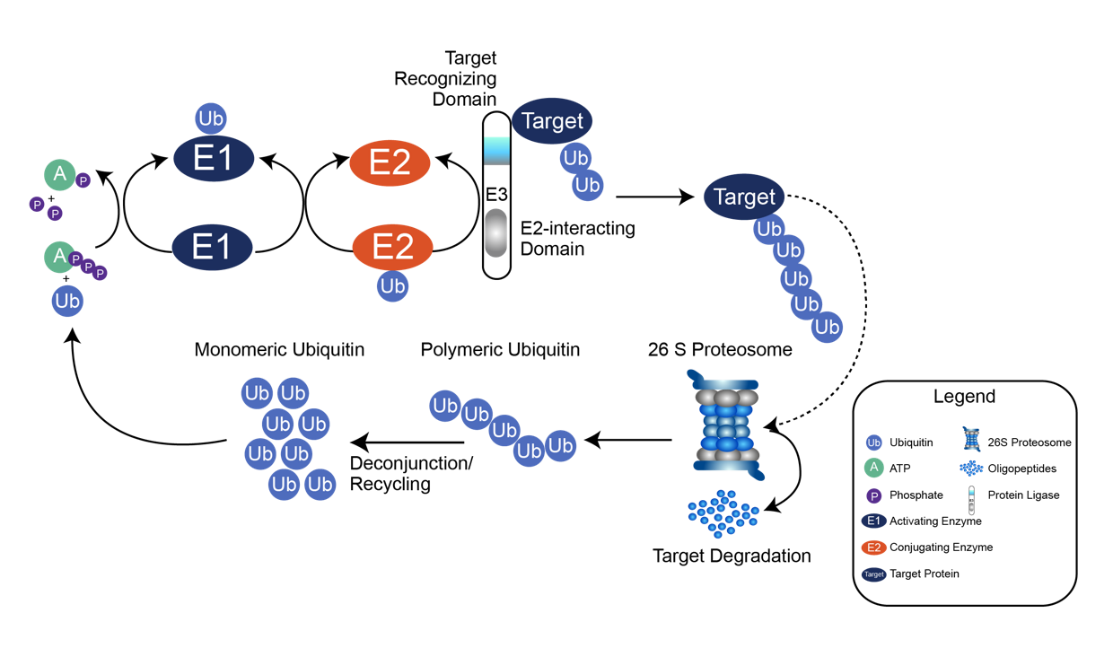
图4 泛素化蛋白的生物学功能
应用场景
1. 蛋白质质量控制与降解
囊性纤维化跨膜传导调节因子(CFTR)的错误折叠蛋白被 E3 泛素连接酶 TRIM39 泛素化,通过蛋白酶体降解,其异常降解导致囊性纤维化。
2. 信号通路与细胞周期调控
DNA 损伤应答:ATM 激酶激活后,促进组蛋白 H2AX 的泛素化(由 E3 酶 RNF8/RNF168 介导),招募修复蛋白到损伤位点。
细胞周期:后期促进复合体(APC/C)通过泛素化降解周期蛋白 B,推动细胞从 M 期进入 G1 期。
3. 疾病机制与治疗靶点
癌症:E3 连接酶 MDM2 过度表达导致 p53 泛素化降解,促进肿瘤发生。泛素化蛋白组学发现,肺癌中 K48 泛素化修饰的抑癌基因 PTEN 水平降低,与 PI3K 通路激活相关。
神经退行性疾病:阿尔茨海默病中,tau 蛋白的异常泛素化形成神经原纤维缠结,其泛素化位点(如 K274)可作为潜在诊断标志物。
乳酸化蛋白组
乳酸化蛋白组(Lactylome) 指细胞中所有被乳酸(Lactate)修饰的蛋白质及其修饰位点的集合。2019 年Nature报道组蛋白的乳酸化修饰(Lys-lactylation),揭示了糖代谢产物参与表观遗传调控的新机制。
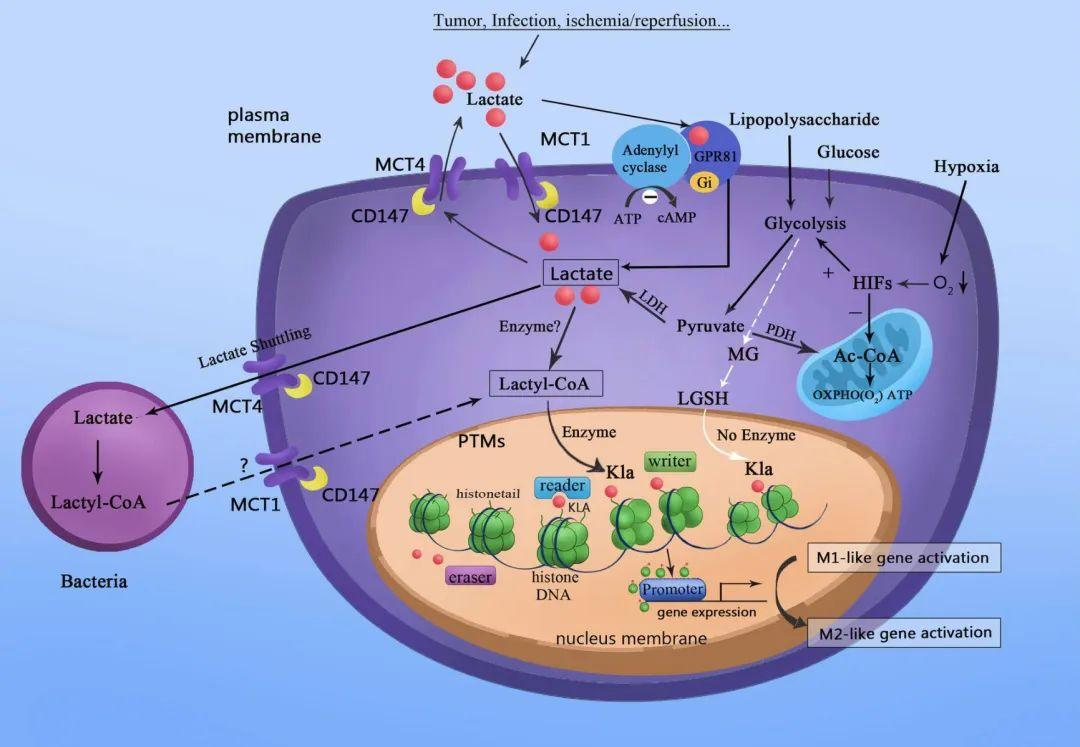
图5 乳酸化蛋白的生物学功能
应用场景
1. 代谢重编程与基因表达调控
肿瘤 Warburg 效应中的作用:癌细胞糖酵解增强,胞内乳酸积累,驱动组蛋白 H3K18、H4K5 乳酸化,激活原癌基因(如 c-Myc)转录。胶质母细胞瘤中,LDH-A(乳酸脱氢酶 A)高表达导致乳酸堆积,促进 H3K122 乳酸化,增强缺氧诱导因子 HIF-1α 的转录活性。
免疫细胞极化调控:M1 型巨噬细胞糖酵解活跃,胞内乳酸化修饰组蛋白 H3K27,抑制抗炎基因(如 IL-10)表达;而 M2 型巨噬细胞以氧化磷酸化为主,乳酸化水平降低。
2. 应激响应与细胞命运决定
缺氧适应:心肌细胞缺氧时,线粒体丙酮酸转化为乳酸,触发核内 H3K9 乳酸化,抑制凋亡基因 Bax 表达,延长细胞存活时间。
干细胞分化:胚胎干细胞向神经祖细胞分化时,糖酵解增强伴随 H3K27 乳酸化升高,促进神经发生相关基因(如 NeuroD1)的染色质开放。