
【Science & Nature共聚焦】CRISPR治病还为时尚早?最新“十大专利”张锋占6个

一直以来,围绕在张锋与Jennifer Doudna之间的CRISPR专利之争备受瞩目。3月上旬,据《科学》网站报道,美国专利商标局主持召开了一项由法官评判组参与的评审会议,对Borad研究所和加州大学伯克利分校的专利权主张进行审理和裁决。据悉,该评审会议于3月10日启动,或将为期数月。
此前,有报道称,截止到2015年11月,张锋实验室以及Borad研究所关于CRISPR-Cas9的相关专利在美国已经有14个被批准,在欧洲也有4个已经被批准。尽管上述专利之争还未最终定论,但随着技术的不断更新和发展,基因编辑领域的专利分布格局也在不断变化。
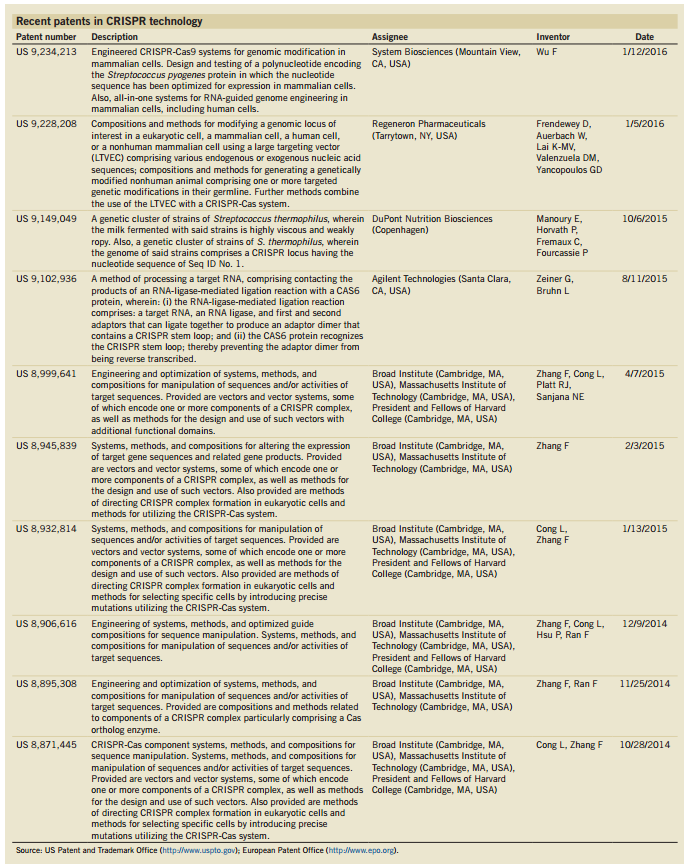
5月6日,在线发表在Nature Biotechnology上的一篇文章盘点了近期CRISPR技术相关的十项专利,其中有6项与张锋相关,具体见下表:
CRISPR治疗疾病还为时尚早
今年3月, 《自然》杂志发表了3篇文章,对超火爆的CRISPR技术进行了讨论,文章表示,基因编辑还只是一个开始,现在已经不是单纯技术问题,已经影响到政策制定和伦理学领域。上周,《科学》网站发表了题为“The gene editor CRISPR won’t fully fix sick people anytime soon. Here’s why”的文章,探讨了这一技术的前景与风险。
文章指出,在能够安全有效的修复人类基因之前,CRISPR还有一段很长的路要走。这是绝大多数人类疾病(如肌肉萎缩症、囊性纤维化)需要面对的事实。基因编辑治疗这些疾病需要在人体中直接修正基因,因为如果先将细胞取出来,再修复好放回体内,很少的细胞能够存活。
在体内直接治疗细胞意味着基因编辑需要面对基因导入方面的障碍。举例来说,研究人员必须找到一种能够将可发挥作用的CRISPR系统导入到人体特定组织中的有效方法。同时,CRISPR还具有安全风险,最常提到的是Cas9酶的脱靶效应,这可能会导致癌症的发生。
CRISPR用于治疗人类疾病还存在一些其它问题,通过该技术删除基因比修正基因要相对容易。这是因为细胞在编辑DNA时需要启动一个叫同源介导修复(homology-directed repair,HDR)的程序,这一程序只会在分裂的细胞中激活。不幸的是,人体中大多数的细胞通常不在分裂状态。
当然,研究者们也在寻找绕过这一限制的方法。张锋表示,HDR相关的基因存在于所有细胞中,那么,也许可以通过添加某种药物到细胞中激活这一程序。此外,另一种途径是寻找一种不依赖于HDR程序的、可替代Cas9的CRISPR系统。
安全隐患
脱靶效应并不是CRISPR技术目前唯一的安全隐患。事实上,研究人员通常是利用病毒载体传递Cas9的DNA到细胞,从而使CRISPR系统在组织中发挥作用。这意味着,在Cas9完成目标切割后,细胞将会继续表达Cas9。对此,张锋表示,Cas9酶将存在超过10年、20年。这带来的问题是,即便是特异性非常高的Cas9也将会产生脱靶切割,从而引发免疫响应。
然而,张锋表示,这可能不会是一个真正的问题。他团队构建了一种一直表达着Cas9基因的小鼠品系,即便是杂交约20代后,小鼠似乎依然“很好”,没有明显的异常健康影响。尽管如此,最理想的情况还是找到一个方法可以在Cas9发挥作用后关闭它。
另一方面,基因疗法长期存在的障碍也是CRISPR需要面对的。基因编辑的细胞最终会死亡,患者不得不接受多次治疗。研究人员使用的基因导入和编辑途径都会受病毒载体可携带DNA量的限制。目前,CRISPR研究者通常必须使用两种不同的病毒载体将CRISPR组件导入到细胞中,这比使用单个载体效率更低。
应用前景
基因治疗研究者Cynthia Dunbar说:“CRISPR技术的出现为基因治疗领域注入了新的活力,这部分是因为与基因导入相比,这一技术有望解决更多的遗传性疾病,其中包括一些免疫性疾病,这类患者的修复蛋白数量必须精确控制。在其它情况下,如镰状细胞病,除非患者的细胞不再产生缺陷蛋白,否则患者不会完全康复,因此,只添加一个基因是不够的。”
基因治疗领域经历了20多年的起起伏伏,这一领域的“老将们”对CRISPR提高疾病治疗的预期持谨慎态度。斯坦福大学的基因治疗研究人员Mark Kay说:“每当有一项新的技术出现,总会带来很大的兴奋,人人都希望它能够用于治愈患者,但,真正实现这一点需要一些时间。”
备注:本文部分内容编译自Science,原标题“The gene editor CRISPR won’t fully fix sick people anytime soon. Here’s why”。
本文转自生物探索

扫一扫,反馈当前页面
和元生物