光遗传学(optogenetics)是结合了光学(optics)及遗传学(genetics)的技术,借助其,我们能在活体动物甚至是自由运动的动物脑内、脊髓、外周神经内,精准地控制特定种类神经元的活动。光遗传学在时间上的精确度可达到毫秒级别,在空间上的精确度则能达到单个细胞级别。2010年,光遗传学被Nature Methods选为年度方法,同年被Science认为是近十年来的突破之一。这项技术目前在神经科学领域应用非常广泛,未来可能会应用于多种神经和精神疾病的治疗,如帕金森氏病、阿尔茨海默病、癫痫、脊髓损伤、精神分裂症等。
图1.光遗传学技术
1)光遗传学技术发展史
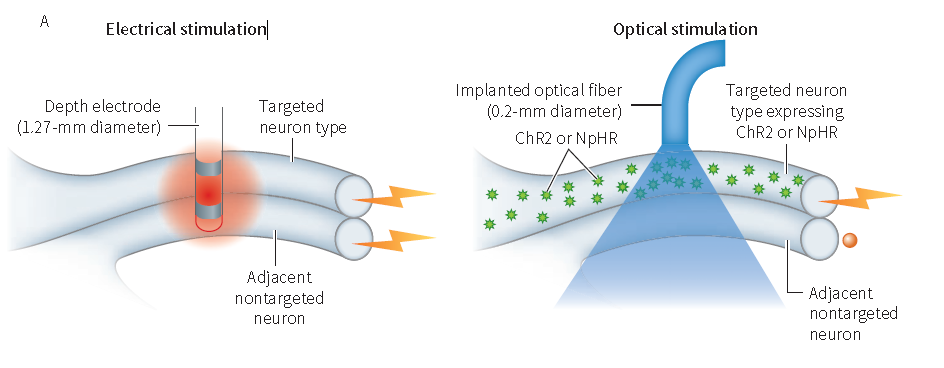
谈及光遗传学技术的由来,我们不得不思考神经科学的基本研究需求:精确控制神经元活动。1979年,诺贝尔奖得主Francis Harry Compton Crick首次提出,为了解大脑如何运作,我们需要一种方法,可以每次只让某一特定类型神经元活动被抑制,而不影响其他神经元的活动。为了实现这个目标,人们过去通常采用电刺激来激活一群神经元活动,但其具有两大难以克服的缺点(图2),其一在于该操作的非选择性,即电场会同时刺激多种类型神经元,所得出的研究结果往往缺乏特异性,其二是只能激活而无法抑制神经元活动。随着基因工程技术的发展,科学家开始利用化学药物联合转基因技术来精确定位特定的神经元并进行相关研究,尽管解决了特异性问题,但是化学刺激的方法在时间上的精确度缺乏保证。因而,一种高精确性,能够激活或抑制特定种类神经元活动的方法成为研究的“刚需”,光遗传学技术正解决了此问题。
图2 光遗传学与电刺激操控细胞的差异(Karl Deisseroth, et al., Annu. Rev. Biomed. Eng., 2014)
早在1973年,微生物学家便发现细菌视紫质(Bacteriorhodosin)光照之后会成为离子转运蛋白,1977年发现盐细菌视紫红质(Halorhodopsin,NpHR)也是离子转运蛋白,照黄绿光后会将阴离子打进细胞,2002年发现光敏感通道(Channelrhodopsins),蓝光照射之后会将阳离子打进细胞。
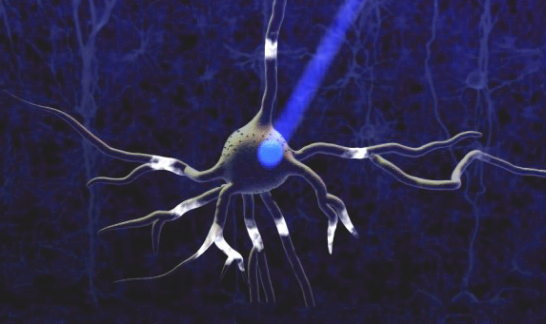
2005年9月份,斯坦福大学的Karl Deisseroth实验室在Nature Neuroscience上发表了一篇Technical Report,第一次将Channelrhodopsin-2(ChR2)表达在神经元里,发现可以用蓝光精确地控制神经元的活动(图2),而光遗传学(optogenetics)一词也随之出现。随后发现Bacteriorhodosin与Halorhodopsin也都能在神经元表达,准确调控神经元的活动,并不会对神经元产生毒害作用。此后,光遗传学迅速改变神经科学界,成为研究特定神经元在大脑中扮演何种角色不可或缺的工具。
图3.将ChR2表达在神经元膜上,然后用470nm蓝色激光进行照射
2)光遗传学技术基本原理
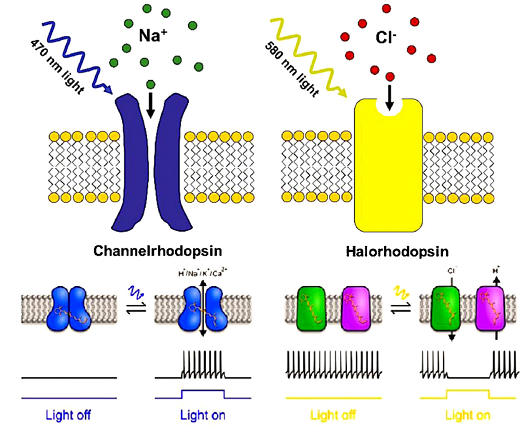
简单地说,光遗传学技术即借助遗传学手段,将能够对光起响应的通道表达在特定细胞中,实现通过光来激活或抑制神经元活动的目标。其中,激活或抑制的原理在于不同通道对阳离子或阴离子的通透(图4):如果转入细胞的通道是ChR通道,那么在细胞接受蓝色激光照射时通道开放,阳离子内流,会产生去极化电位,诱发动作电位的发出,激活细胞;如果转入细胞的是HR一类通道的话,细胞接受黄色激光照射时阴离子内流,产生超极化电位,导致动作电位不易发放,抑制细胞活动;此外,还有一类光激活或抑制的通道optoXR,给光激活后其改变的是胞内激酶系统,影响细胞活动。因此,光遗传学技术的核心技术差异在于光敏感通道的选择。
图4.光遗传学的基本原理(以ChR2和NpHR为例)
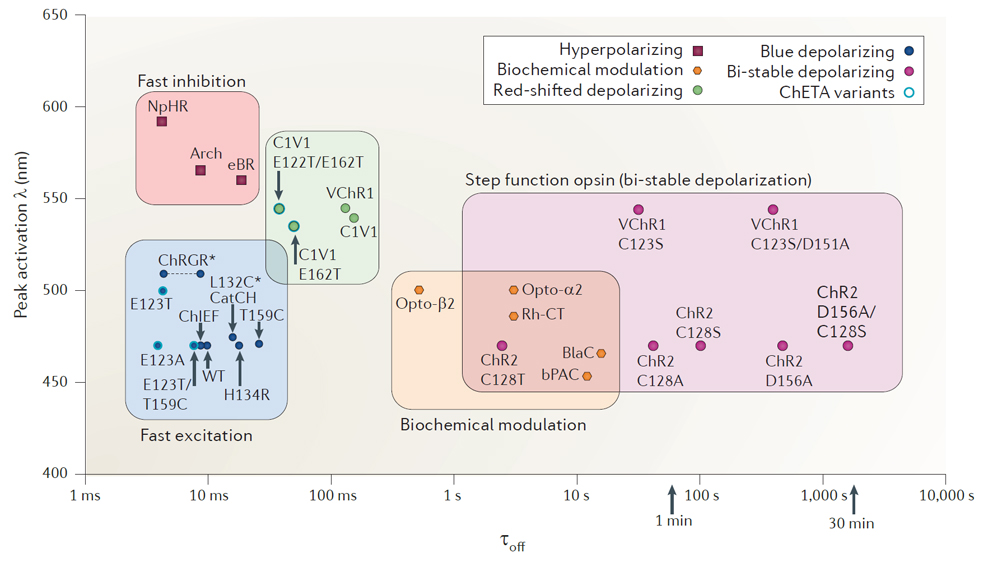
3)常见的光敏感通道
几种激活神经元的通道蛋白:
1、ChR2(H134R):ChR2的突变体,将第134个氨基酸由组胺酸突变为精胺酸,该蛋白质可以产生两倍的光电流,但通道开关速度也比野生的ChR2慢了一倍;
2、ChR2(C128S/D156A): ChR2的突变体,超灵敏光敏感通道,用蓝色激光打开通道,然后用绿色或黄色激光关闭通道,可以打开其离子通道长达30分钟;
3、ChR2(E123T/T159C): ChR2的突变体,更大的光电流和更快的动力学变化;
4、ChETA:ChR2的突变体,使得神经元在激光刺激下可以发放200Hz的spike,而其他的ChR2 通道蛋白只能达到40Hz;
5、C1V1:由ChR1及由团藻发现的VChR1组合在一起的通道蛋白,在红色激光刺激下打开通道;
6、oChIEF:响应高频光(--100Hz)刺激,加速通道关闭的速度,在持续光照刺激下减少失活率;
7、ST-ChroME:胞体定位,激活型ChroME通道。
几种抑制神经元活动的通道蛋白
1、NpHR:即为Halorhodopsin,第一个有效抑制神经元活动的光遗传学工具,在黄绿激光照射下会将氯离子打进神经元内,而抑制神经元活动。当把NpHR表达在哺乳动物脑内时,会聚集在内质网上,而如果将内质网输出元件加在NpHR基因序列后面,这样可以使得NpHR在胞内高量表达,而且不会聚集在内质网上,这样修改过的NpHR被称为eNpHR2.0。但是eNpHR2.0在细胞膜的聚集仍然不够,而将一个高尔基体输出元件和来自于钾离子通道Kir2.1的上膜元件加在eNpHR2.0基因序列后面,这样就能实现在神经元细胞膜上的高量聚集,这样修改过的NpHR被称为eNpHR3.0,eNpHR3.0的响应时间短,反应灵敏。
2、Arch:即为archaerhodopsin,是一种黄色激光激活的外向整流质子泵,能够将带正电的质子从神经元内移动到细胞外环境中,使神经元处于超极化状态。在特定条件下,可用于增加细胞内pH或减少细胞外基质pH。和NpHR相比,当激光关闭的时候,Arch立即从通道打开状态恢复到关闭状态。
3、Mac:即为 Leptosphaeria maculans fungal opsins,蓝色激光激活的质子泵,能够将带正电的质子从神经元内移动到细胞外环境中,使神经元处于超极化状态。
4、IRES-ST-eGtACR1:胞体定位,快速抑制。
图5常见光敏感通道特性(Karl Deisseroth’s, Nat Methods,2012)
更多光遗传学病毒工具请搜索。。。
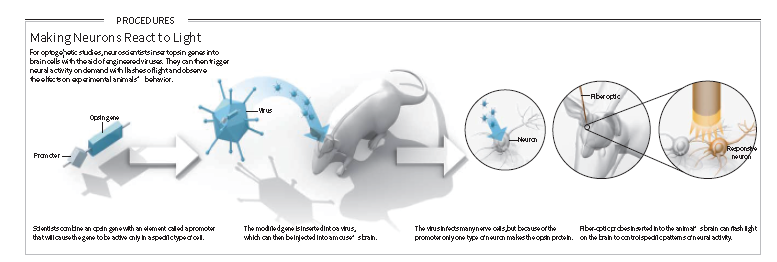
4)光遗传学技术的应用策略
借助病毒载体的光遗传学技术应用一般包括以下几个关键步骤(图6):
1、 根据实验需求寻找合适的光敏蛋白;
2、通过病毒载体感染细胞,将光敏感通道表达在靶细胞中;
3、手术手段向脑中导入光纤,通过控制激光来实现对神经元活动的精准控制;
4、选择合适的病毒表达时间,结合行为实验设置合理的试验方案;
5、行为学手段或电生理手段验证。
图6. 光遗传学技术的一般策略(Karl Deisseroth, Scientific American, 2010)
5)光遗传学技术优势
1、时间精确度高:光遗传技术可以通过控制激光使时间精准度到毫秒级别甚至是亚毫秒级;
2、刺激的强度精确性高:光遗传技术通过控制激光,可以精准地、随时地调节给神经元刺激的强度,这对于某些刺激强度依赖的神经环路研究有不可替代的优势;
3、空间特异性:光遗传学技术可以通过脑定位注射、特异性启动子、甚至是亚细胞器定位肽,将光敏感蛋白锚定在靶向细胞或细胞器进行操作,可达到单个细胞的级别,实现精准定位;
4、作用工具多样:目前人们已经突变了一系列新的光敏感通道,这些通道的时间特性和激发光要求都不同,可根据具体的实验需求进行选择;
5、作用直接:不像DREADDs技术依赖于动物代谢水平,光遗传学技术通过激光操控细胞的激活或抑制,作用直接。
表1 光遗传与化学遗传优缺点比较
光遗传学技术 DREADDs技术
时间上 时间精准度到毫秒级别甚至是亚毫秒级 小时级,可实现长达数小时持续激活或抑制神经元活动而不影响细胞正常生理
空间上 通过脑定位注射、特异性启动子、亚细胞器定位肽,将光敏感蛋白锚定在靶向细胞或细胞器进行操作,可达到单个细胞的级别 通过定位注射、特异性启动子将DREADDs受体锚定某类特定的细胞
操作技术 开颅手术埋置光纤,需要光纤、激光控制器等,操作相对有难度 非浸入性,只需常规药理学技术手法,注射或者喂食CNO即可
光遗传学应用案例
1、oChIEF:
客户发表文章:Nature. (IF=41.577). Yang Y,et.al. (2018). Ketamine blocks bursting in the lateral habenula to rapidly relieve depression. [腺相关病毒, 抑郁症, 光遗传]
注射部位:小鼠LHb
载体:AAV2/9-hSyn-oChIEF-tdTomato
血清型:AAV2/9
病毒滴度:6.29× 1012 VG/mL
注射体积:100nl
观察时间:1个月
2、ChR2(H134R)& eNpHR3.0
客户发表文章:Science. (IF=41.058). Mu D,et.al. (2017). A central neural circuit for itch sensation. [腺相关病毒, 痒, 光遗传,化学遗传]
注射部位:小鼠脊髓
载体:AAV-EF1a-DIO-ChR2(H134R)-mCherry& AAV-hSyn-eNpHR3.0-EYFP
血清型:rAAV2/9
病毒滴度:5.1× 1012 VG/mL&1.7× 1013 VG/mL
注射体积:400-600nl