
Nature深度好文:女神告诉你,CRISPR让CAR-T继续“开车”
 2016年年底,来自加州大学伯克利分校的几位科学家在Nature Reviews Drug Discovery(影响因子47.12)杂志上发表了一篇题为“Cornerstones of CRISPR–Cas in drug discovery and therapy”的综述文章。CRISPR“女神”Jennifer A. Doudna教授是这篇文章的共同作者。
2016年年底,来自加州大学伯克利分校的几位科学家在Nature Reviews Drug Discovery(影响因子47.12)杂志上发表了一篇题为“Cornerstones of CRISPR–Cas in drug discovery and therapy”的综述文章。CRISPR“女神”Jennifer A. Doudna教授是这篇文章的共同作者。
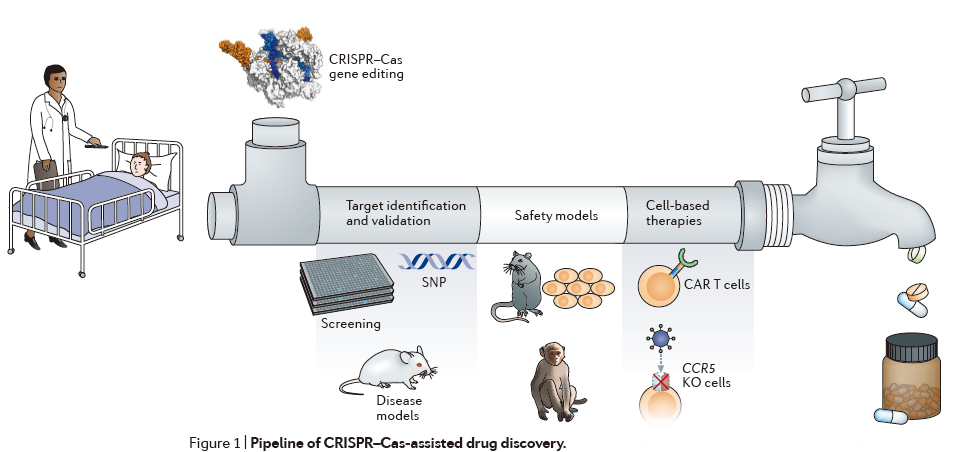 这一综述主要包括以下四个部分:1)CRISPR–Cas作为一种药物发现工具(CRISPR–Cas as a tool for drug discovery);2)CRISPR系统的特异性(Specificity of CRISPR systems);3)利用CRISPR–Cas开发治疗方法(Using CRISPR–Cas to make therapeutics);4)定义通往临床之路(Defining a path to the clinic)。
这一综述主要包括以下四个部分:1)CRISPR–Cas作为一种药物发现工具(CRISPR–Cas as a tool for drug discovery);2)CRISPR系统的特异性(Specificity of CRISPR systems);3)利用CRISPR–Cas开发治疗方法(Using CRISPR–Cas to make therapeutics);4)定义通往临床之路(Defining a path to the clinic)。
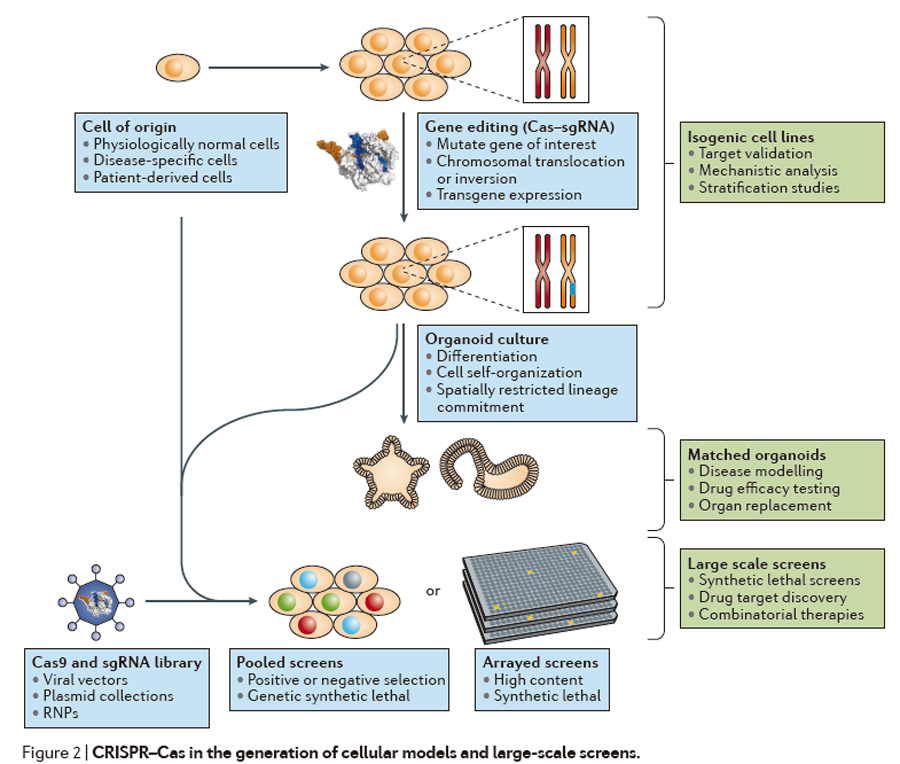
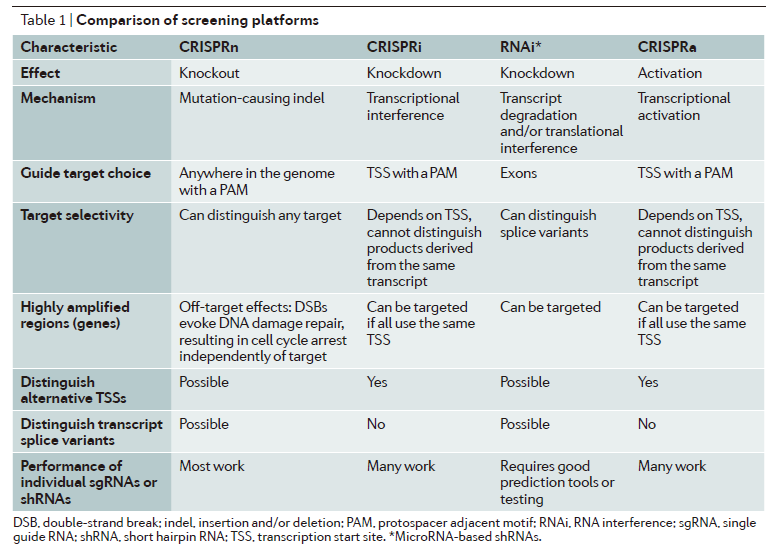
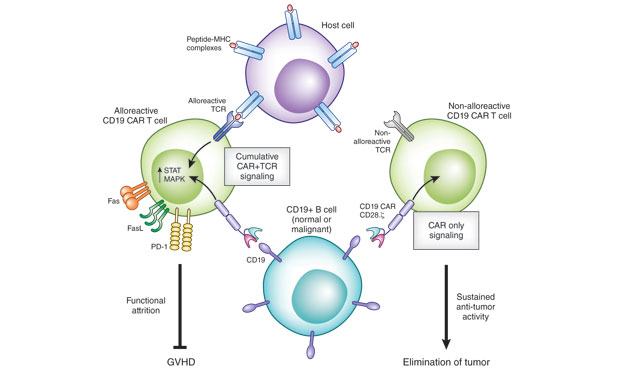 除了用于产生“off-the-shelf”版本的CAR-T细胞,基因组编辑技术还可以通过敲除编码T细胞抑制性受体或信号分子的基因(如CTLA4、PD1)提高CAR-T细胞的功效。在这部分内容中,作者们提到了美国NIH下属Recombinant DNA Advisory Committee批准的将由CAR-T大牛Carl June教授领导的一项CRISPR临床试验。在该试验中,研究人员将利用Cas9在黑色素瘤靶向的CAR-T细胞中敲除编码PD-1的基因以及内源性T细胞受体的基因。此前,据Nature Biotechnology杂志报道,研究团队计划在今年第一季度开始I期临床试验。【详细】
除了用于产生“off-the-shelf”版本的CAR-T细胞,基因组编辑技术还可以通过敲除编码T细胞抑制性受体或信号分子的基因(如CTLA4、PD1)提高CAR-T细胞的功效。在这部分内容中,作者们提到了美国NIH下属Recombinant DNA Advisory Committee批准的将由CAR-T大牛Carl June教授领导的一项CRISPR临床试验。在该试验中,研究人员将利用Cas9在黑色素瘤靶向的CAR-T细胞中敲除编码PD-1的基因以及内源性T细胞受体的基因。此前,据Nature Biotechnology杂志报道,研究团队计划在今年第一季度开始I期临床试验。【详细】
 第四部分:关于临床
第四部分:关于临床

扫一扫,反馈当前页面
和元生物