
公司合作客户武汉大学宋保亮教授再发高分文章
【Nature Cell Biology】里程碑!武汉大学宋保亮教授发文揭示脂质调控机体代谢的新机制
胆固醇和游离脂肪酸是我们机体常见的脂类,不仅是机体细胞基本膜结构的基本成分,而且参与了机体基本生理功能,比如血糖稳态的调控。机体中胆固醇和游离脂肪酸过度沉积,会促进活性氧(Reactive Oxygen Species,ROS)的生成[1,2],从而导致胰岛素抵抗诱发2型糖尿病[3]。然而,对于脂质沉积导致的氧化应激信号,机体细胞是如何去感受并应答的呢?现在还是未知的。如果可以揭示该生理过程,那么对于治疗由于脂类沉积导致的代谢性疾病具有重要的临床意义。

武汉大学宋保亮教授和中科院生化细胞所李伯良教授团队合作发现,内质网膜上的acetyl-CoA acetyltransferase 2(ACAT2)通过其277位的半胱氨酸残基发生泛素化修饰而降解。当胆固醇和游离脂肪酸水平过高,会诱导细胞内ROS的生成增加,ROS可氧化其277位半胱氨酸残基,从而抑制 ACAT2的泛素化降解,提高ACAT2稳定性和酶活性,从而将过量有毒的极性脂(胆固醇、脂肪酸)转变为无毒的胆固醇酯,改善胰岛素敏感性。这一研究于今年6月12日发表在Nature Cell Biology上。(文中使用的所有AAV病毒载体均由和元上海提供)

研究思路和结论:
1. 固醇和饱和脂肪酸导致ACAT2蛋白水平的升高
因为胆固醇和游离脂肪酸是ACAT2的底物,因此作者首先检测了固醇和脂肪酸对ACAT2的影响,发现固醇和饱和脂肪酸可以导致ACAT2蛋白水平的升高(图1)。
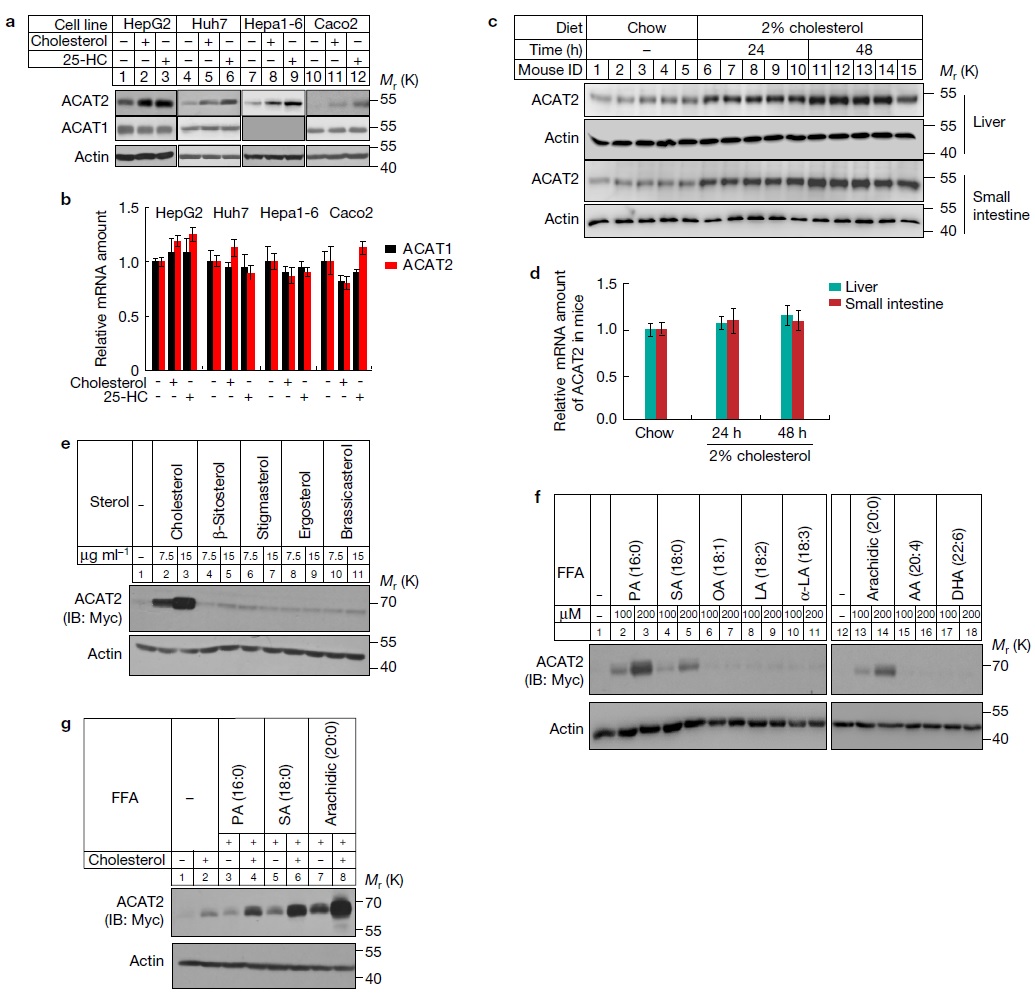
图1. 固醇和饱和脂肪酸增强ACAT2的蛋白稳定性
2. 固醇和饱和脂肪酸抑制ACAT2蛋白在277位半胱氨酸残基的泛素化
ACAT2蛋白水平的升高是由于什么原因导致呢?作者发现当用蛋白酶体的抑制剂MG132单独或者联合固醇、饱和脂肪酸同时处理细胞, ACAT2的蛋白水平量明显增加,提示固醇和饱和脂肪酸可能是通过抑制泛素化导致ACAT2蛋白水平增高(图2a)。进一步作者发现固醇和饱和脂肪酸抑制了ACAT2蛋白在277位的半胱氨酸残基的泛素化(图2b-2i)。
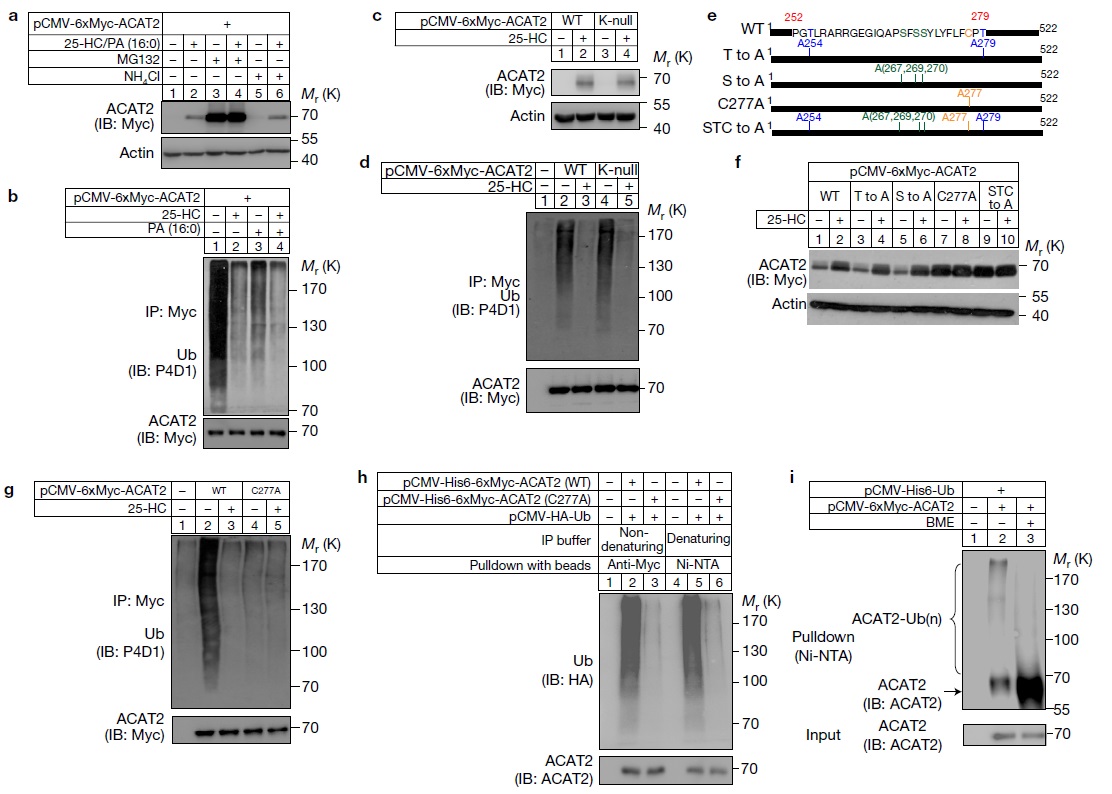
图2. 脂类调控ACAT2蛋白277位半胱氨酸残基的泛素化
那么ACAT2蛋白的泛素化是什么类型的呢?通过突变泛素蛋白不同位点筛选,作者发现泛素蛋白48位的赖氨酸残基是其泛素化ACAT2蛋白的主要位点(图3)。
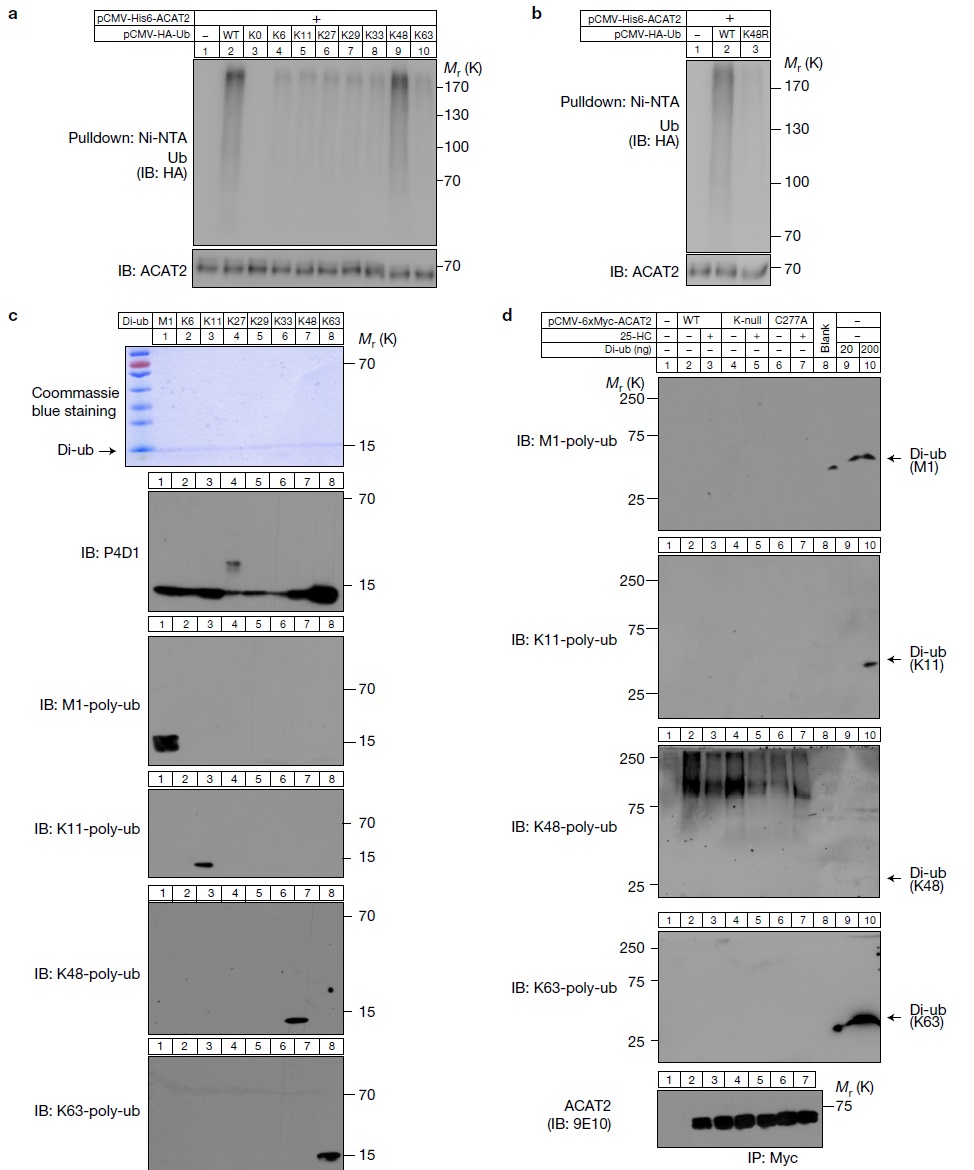
图3. ACAT2被泛素蛋白的48位赖氨酸残基介导发生泛素化
3. 固醇饱和脂肪酸促进ACAT2蛋白277位半胱氨酸残基氧化
蛋白泛素化在赖氨酸残基也可以发生,那么为什么固醇和饱和脂肪酸调控ACAT2蛋白的泛素化会特异的发生在半胱氨酸残基呢?因为之前的研究证明脂类沉积可以促进细胞内ROS的生成,同时半胱氨酸残基容易被氧化,所以作者怀疑胆固醇和饱和脂肪酸可能诱导了ROS的生成,后者导致ACAT2半胱氨酸残基的氧化。作者首先证明了固醇和饱和脂肪酸可以诱导ROS的生成(图4a),细胞内ROS的水平和ACAT2的蛋白水平呈正相关(图4b)。然后通过促进和抑制ROS的生成(图4c-4j),证明了固醇和脂肪酸通过诱导ROS氧化ACAT2的半胱氨酸残基,抑制ACAT2蛋白的降解。
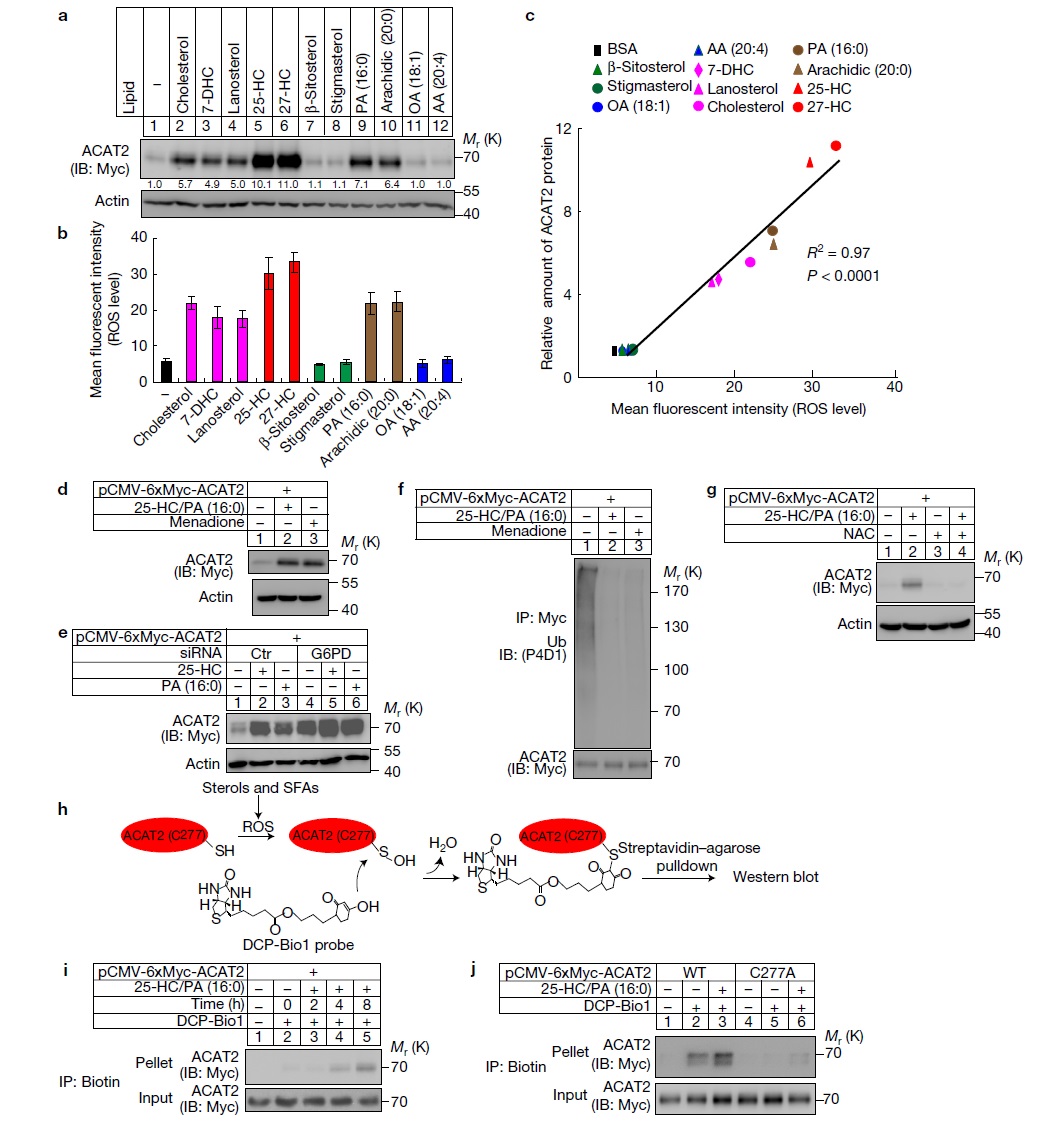
图4. 固醇饱和脂肪酸促进ACAT2蛋白277位半胱氨酸残基氧化
4. gp78-Insigs介导ACAT2蛋白的泛素化和降解
不同蛋白发生泛素化过程中,会有不同的E3泛素连接酶介导完成,那么ACAT2的E3是哪个蛋白呢?之前的研究提示gp78和Insigs参与固醇调控的蛋白泛素化[4],所以作者进一步研究证明gp78-Insigs介导了ACAT2的泛素化降解(图5)。
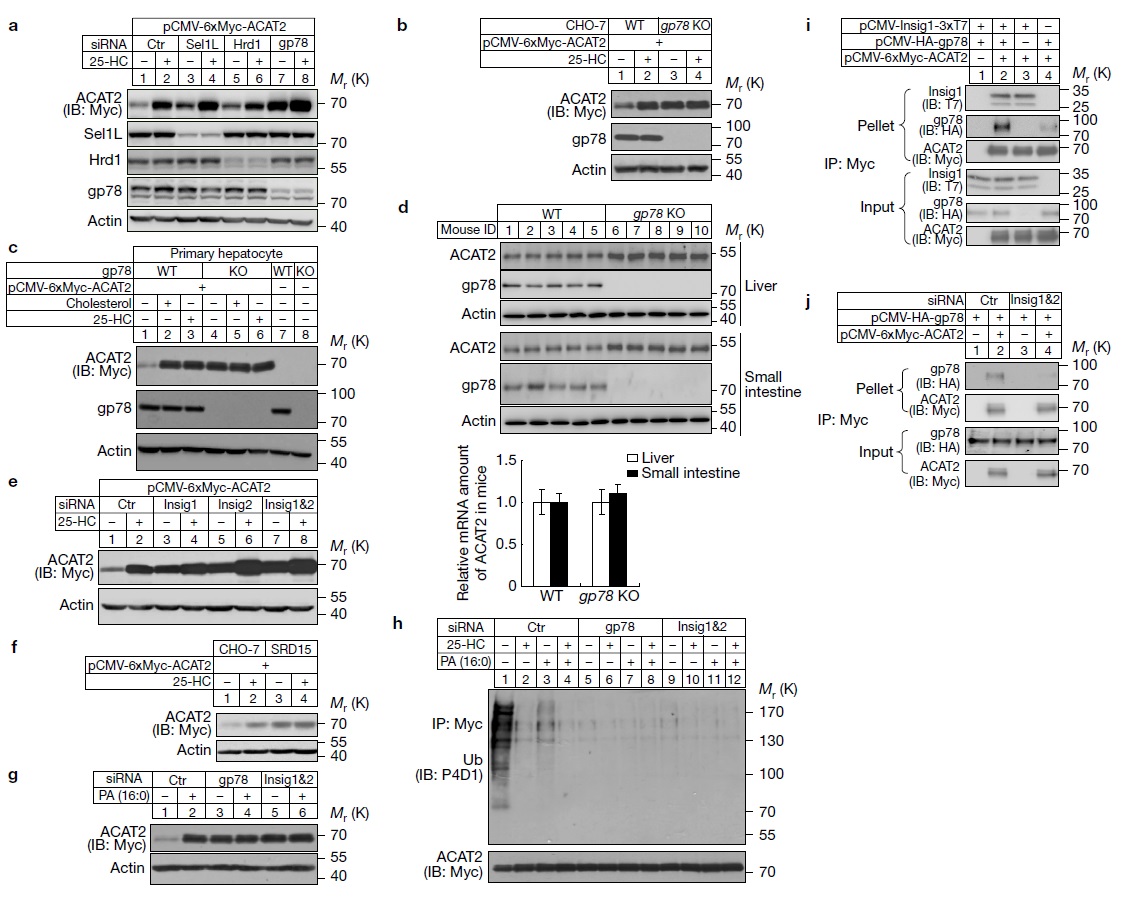
图5. Gp78-Insigs E3泛素连接酶复合体介导了ACAT2的泛素化降解
5. ACAT2敲除小鼠对高脂诱导的胰岛素抵抗更加敏感
体外实验证明,固醇和饱和脂肪酸可以通过诱导ROS氧化ACAT2的半胱氨酸残基,抑制ACAT2蛋白泛素化降解。那么在体内当ACAT2基因被敲除,固醇、脂肪酸和胆固醇酯的水平会发生变化吗?小鼠的胰岛素敏感性会受损吗?作者研究发现,高脂喂养ACAT2敲除小鼠机体内脂肪酸的水平升高,胆固醇酯的水平降低(图6a)。高脂喂养之后ACAT2敲除小鼠出现胰岛素抵抗(图6b-be)。
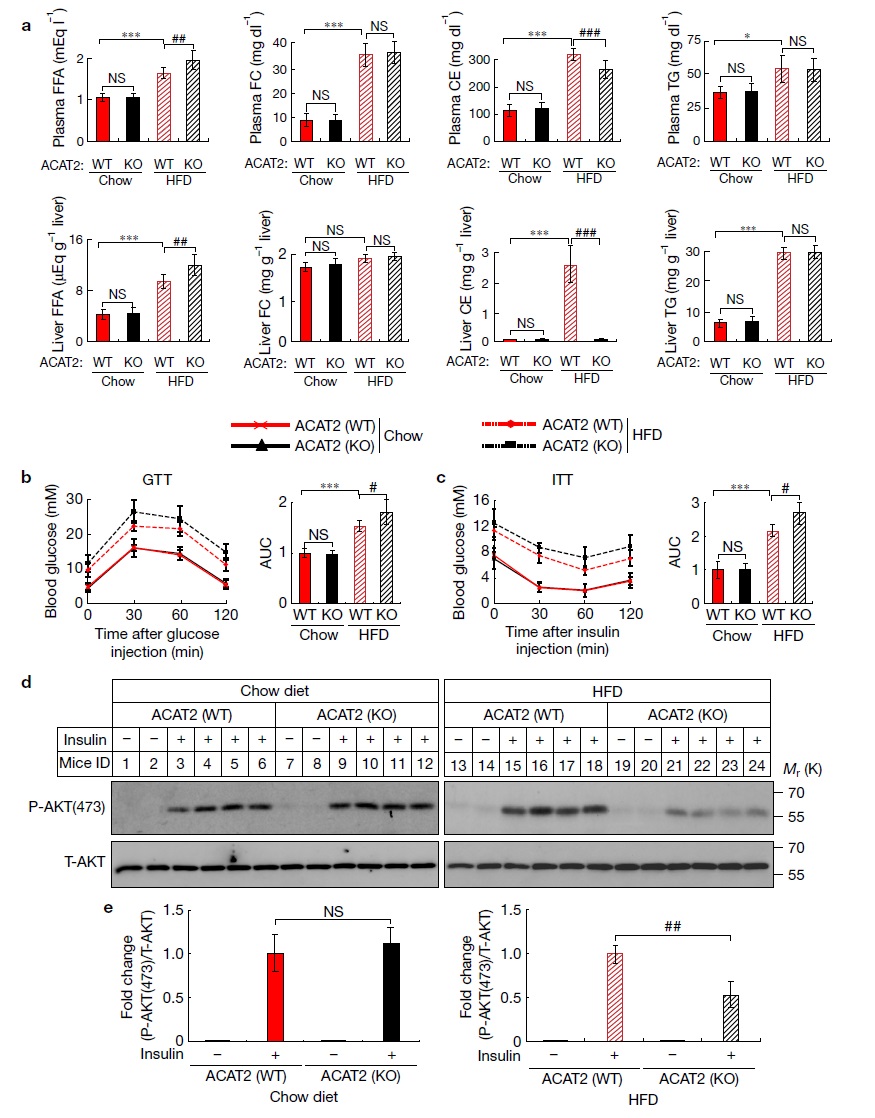
图6. ACAT2敲除小鼠高脂条件下出现胰岛素抵抗
6. 稳定的ACAT2蛋白可以抵抗高脂诱导的胰岛素抵抗
既然ACAT2敲除后发生胰岛素抵抗,那么把ACAT2的泛素化位点突变,抑制ACAT2蛋白的降解,使其稳定表达是否可以抵抗高脂诱导的胰岛素抵抗呢?作者突变了ACAT2蛋白277位的半胱氨酸,并证明该突变不会影响其酶活性(图7a-7c)。通过AAV病毒在小鼠的肝脏中过表达该突变体,小鼠的表型和ACAT2敲除小鼠是相反的,抵抗高脂诱导的胰岛素抵抗(图7d-7h)。
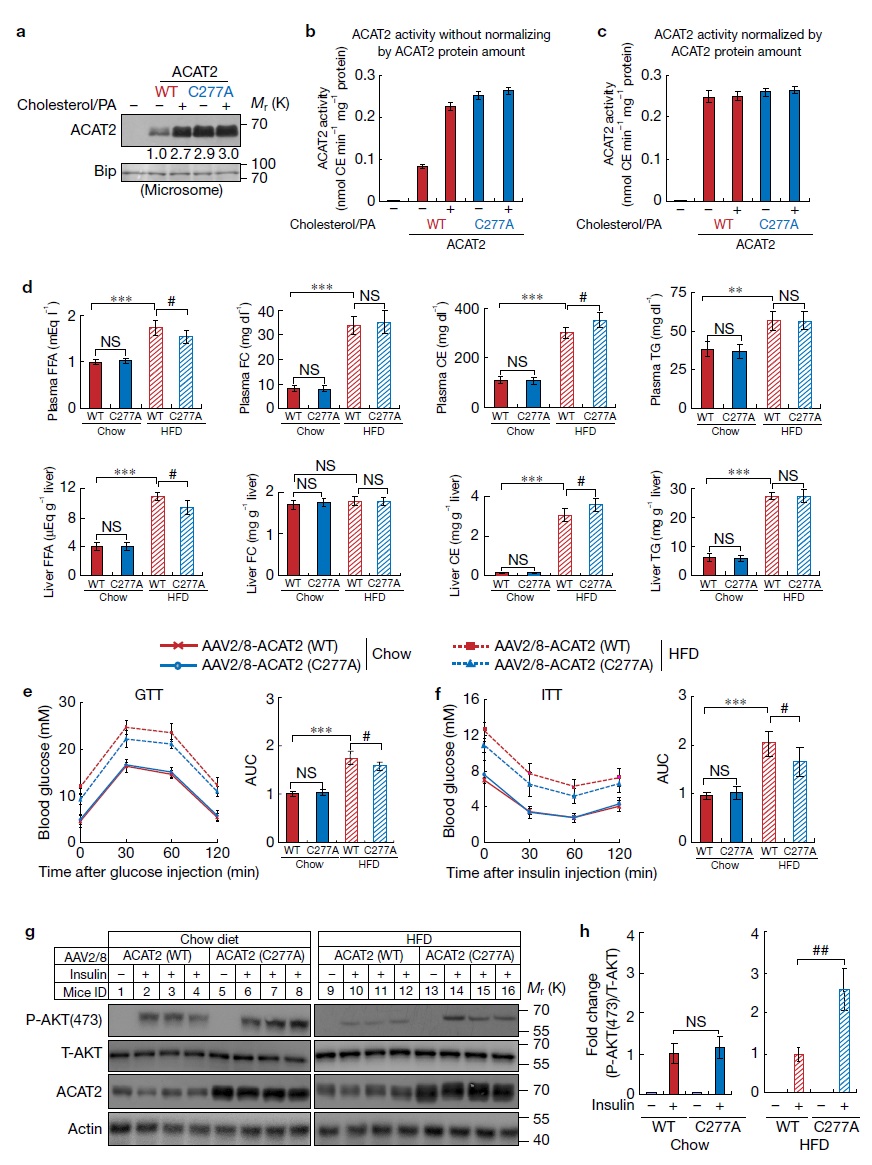
图7. 稳定的ACAT2减轻了肝脏的脂毒性、抵抗高脂诱导的胰岛素抵抗
总结:
该研究工作揭示了细胞适应脂质过度累积引起活性氧增多的分子机制,为糖尿病的药物研发提供新思路。同时,也发现了半胱氨酸残基可以作为蛋白泛素化修饰位点的生理功能。
和元上海始终关注生命科学研究的最新进展,致力于为广大科研工作者提供高质量的病毒工具,助力基础研究和基因治疗!
参考文献:
[1].Anavi, S., Hahn-Obercyger, M., Madar, Z. & Tirosh, O. Mechanism for HIF-1 activation by cholesterol under normoxia: a redox signaling pathway for liver damage. Free radical biology & medicine 71, 61-69, doi:10.1016/j.freeradbiomed.2014.03.007 (2014).
[2].Brodeur, M. R., Bouvet, C., Barrette, M. & Moreau, P. Palmitic acid increases medial calcification by inducing oxidative stress. Journal of vascular research 50, 430-441, doi:10.1159/000354235 (2013).
[3].Boden, G. Obesity, insulin resistance and free fatty acids. Current opinion in endocrinology, diabetes, and obesity 18, 139-143, doi:10.1097/MED.0b013e3283444b09 (2011).
[4].Song, B. L., Sever, N. & DeBose-Boyd, R. A. Gp78, a membrane-anchored ubiquitin ligase, associates with Insig-1 and couples sterol-regulated ubiquitination to degradation of HMG CoA reductase. Molecular cell 19, 829-840, doi:10.1016/j.molcel.2005.08.009 (2005).
