随着测序技术尤其是高通量测序技术的迅速发展,人们对基因组变异/基因表达差异与表型之间关系的认识越来越深刻。然而传统的Bulk RNA测序手段是针对细胞集合进行测序,而单个细胞特异性的信息往往被掩盖,导致错失很多重要信息。
10X Genomics平台首先利用微流控技术分选单个细胞,然后将带有barcode和引物的凝胶珠以及单个细胞包裹在油滴中;在油滴中凝胶珠溶解释放反转录oligo,细胞裂解释放mRNA,通过SMART法获得用于测序的带barcode的cDNA;液体油层破坏后,cDNA进行后续文库构建,使用Illumina测序平台检测,即可一次性获得大量单细胞的基因表达数据,10min内自动完成多至80,000个细胞的捕获,细胞捕获率最高65%。可实现大量大细胞的快速高效标记、测序和分析,获得单细胞水平的基因表达谱和差异情况,并通过对复杂细胞群体进行深入细致分析,绘制大规模单细胞表达图谱。
 样本类型
样本类型
超高的细胞通量,利用10X Genomics平台实现真正的单细胞测序。
细胞捕获效率高,可实现大量大细胞的快速高效标记、测序和分析。
项目周期短,技术应用范围广。
 技术路线
技术路线
-
组织裂解
-
单细胞悬液
-
细胞质检
-
单细胞标记
-
文库构建
-
上机测序
-
数据分析
 分析内容
分析内容
|
1. 测序数据质控和定量 |
测序序列统计与质控 |
|
数据定量 |
|
多样本数据合并和定量均一化 |
|
最终鉴定细胞表达量矩阵 |
|
2.细胞亚群分类 |
细胞过滤 |
|
单细胞亚群分类 |
|
3.Marker基因分析 |
|
|
4.差异基因富集分析 |
差异基因GO富集性分析 |
|
差异基因KEGG富集性分析 |
 样本类型
样本类型
细胞悬液,组织等
 代表性文章
代表性文章
Zheng H , Pomyen Y , Hernandez M O , et al. Single cell analysis reveals cancer stem cell heterogeneity in hepatocellular carcinoma[J]. Hepatology, 2018.
Park J , Shrestha R , Qiu C , et al. Single-cell transcriptomics of the mouse kidney reveals potential cellular targets of kidney disease[J]. Science, 2018:eaar2131.
 案例展示
案例展示
Hepatology:单细胞分析显示肝癌干细胞的异质性
论文标题:Single-cell analysis reveals cancer stem cell heterogeneity in hepatocellular carcinoma
刊登日期:2018年7月
发表杂志:Hepatology
影响因子:14.079
研究机构:美国国家卫生研究院国家癌症研究所、曼谷朱拉蓬研究所、弗雷德里克国家癌症研究实验室
样本类型:肝癌细胞系(HuH1和HuH7) ,手术切除肿瘤样本P1
技术手段:单细胞测序(10X Chromium、SMART-seq)、流式分选
研究背景:
肝细胞癌(HCC,hepatocellular carcinoma)的肿瘤内分子异质性部分归因于肝癌干细胞(CSC,hepatic cancer stem cells)的存在。 由各种细胞表面标志物定义的不同CSC群体可能包含不同的致癌驱动因素,这在定义靶向疗法时构成了挑战。 研究人员在单细胞水平(10X Chromium、SMART-seq)上整合转录组学和功能分析用以评估CSC的异质性程度。结果表明,CSC在单细胞水平上的表型、功能和转录均存在异质性性,不同的CSC亚群具有不同的分子特征。而且有趣的是,不同CSC亚群内的不同基因与HCC预后相关,并且彼此相互独立,表明CSC异质性影响肿瘤内异质性和肿瘤进展。
文章结果:
大量数据表明CD13、CD24、CD44、CD90、CD133、EpCAM等表面标志物可以定义CSC,研究人员选择CD24、CD133、EpCAM分选HuH1和HuH7不同细胞亚群,用于研究CSC生物学和分子水平异质性。免疫荧光染色表明,在两种细胞培养形态下(单层培养、球体培养),两个HCC细胞系均表现出明显的细胞异质性。
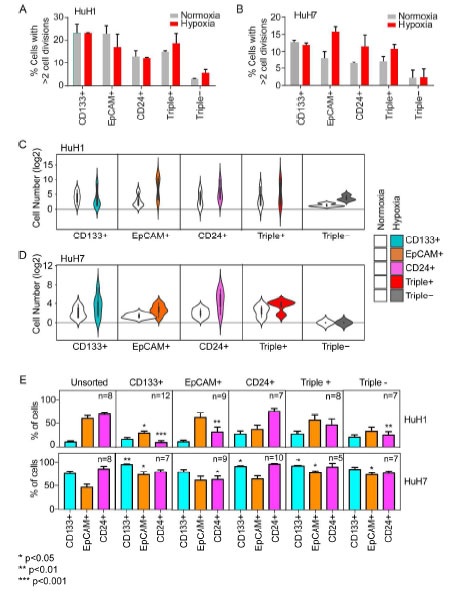
HuH1和HuH7细胞系(原始细胞数分别是1343、1134)正常培养和缺氧培养(促进细胞干性)2周后,研究人员依照三种表面标志物(CD24、CD133、EpCAM)分选细胞,HuH1和HuH7中标志物阳性的CSCs比例分别为15-20%、8-12%,而标志物阴性CSCs比例只有0-5%(下图A-B),培养后不同细胞亚群的自我更新能力差异很大(下图C-D); 分选后的细胞经过1个月培养后,和未分的得细胞相比,CD133+、EpCAM+、CD24+、Triple+细胞能够扩大成为混合CSCs,而存活下的Triple-细胞能够扩大成混合CSCs,可能是由于部分细胞不是真正的标记阴性细胞,或者标记阴性细胞经历了转换变为标记阳性细胞(下图E)。
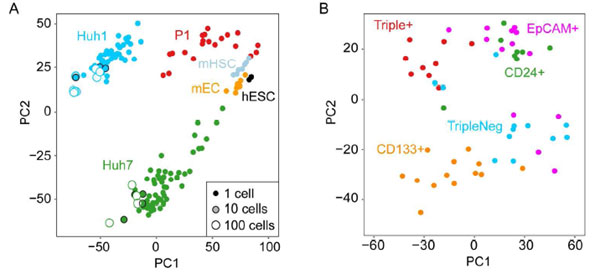
研究人员采用SMART-Seq方式分析HuH1和HuH7阳性标记细胞以及分选的P1(分选CD133+/CD24+/EpCAM+/CD45-细胞)细胞表达谱(单个细胞测序、10细胞混合测序、100细胞混合测序)信息,并与数据库中人胚胎干细胞(hESC)、鼠内皮细胞(mEC)和鼠造血干细胞(mHSC)表达谱数据做了比较,发现不同细胞类群具有不同的基因表达模式,且不同类型细胞中每个细胞的基因表达模式均存在差异,HuH7细胞间差异大于HuH1;当细胞混合(10细胞混合、100细胞混合)后这种差异程度明显降低(下图A)。而当单独聚类HuH7细胞时,发现不同标记细胞彼此可以区分(下图B)。以上数据均表明单细胞水平上转录组存在异质性。
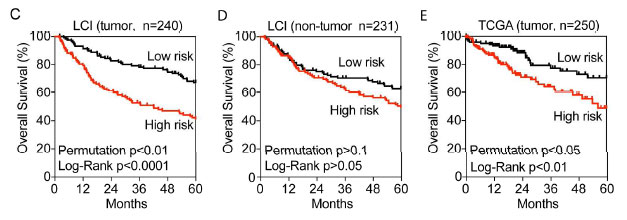
研究人员比较了HuH7阳性标记细胞(Triple+)和阴性标记细胞(Triple-)基因表达差异,鉴定到的286个Triple+相关基因可以预测来自LCI队列的240例肿瘤样本、来自TCGA的250例肿瘤样本的整体生存率,但在非肿瘤样本中无意义。
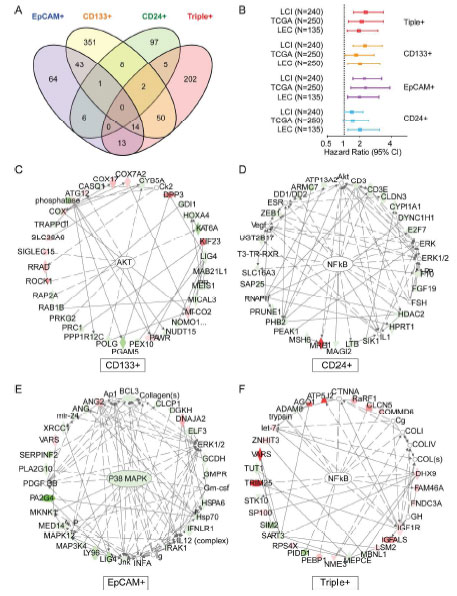
不同标记CSC细胞群体基因表达比较分析,EpCAM+、CD133+、CD24+、Triple+特征基因基本不重合(下图A),IPA通路分析也表明不同细胞群体的通路也不重合(下图C-F),而且不同细胞群体特征基因可以用于生存期预测,且EpCAM+、CD133+比CD24+更有优势(下图B)。
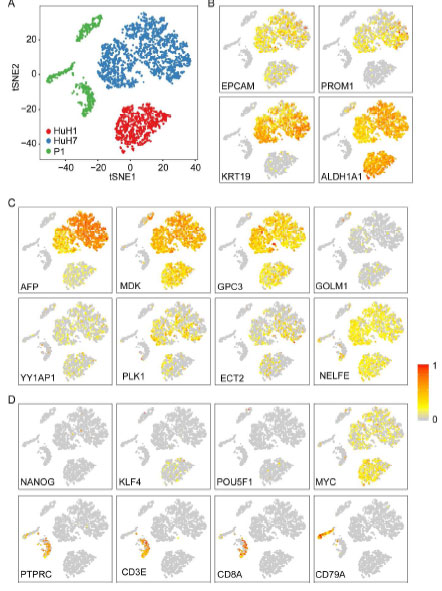
为了整体了解细胞群体多样性,研究人员采用10X 单细胞测序方式,对3847个HuH1、HuH7、P1细胞进行了分析, HuH1可以分为2个亚群,HuH7分为4个细胞亚群,P1分为3个细胞亚群,细胞聚类结果与与SMART-seq结果类似(下图A)。CSC标志物,例如EpCAM、CD133 (PROM1)、CK-19 (KRT19) 和乙醛脱氢酶 (ALDH1A1) (下图B)以及HCC特异基因,AFP、MDK、GPC3、GOLM1、YY1AP1、PLK1, ECT2、NELFE(下图C)在不同细胞亚群中表达存在异质性。P1的3个细胞亚群中表达了山中因子 (KLF4、POU5F1、MYC), 干细胞marker (NANOG),白细胞marker(PTPRC), T细胞 markers (CD3E, CD8A) 和B细胞marker (CD79A) ,但其表达也存在异质性,其中第一个和第二个P1亚群为HCC浸润白细胞(分别表达T细胞marker和B细胞marker),第三个P1亚群主要为HCC细胞(下图D)。
 参考文献
参考文献
Hongping Zheng,et al. Single cell analysis reveals cancer stem cell heterogeneity in hepatocellular carcinoma. Hepatology, 2018, doi:10.1002hep.29778
 结果展示
结果展示
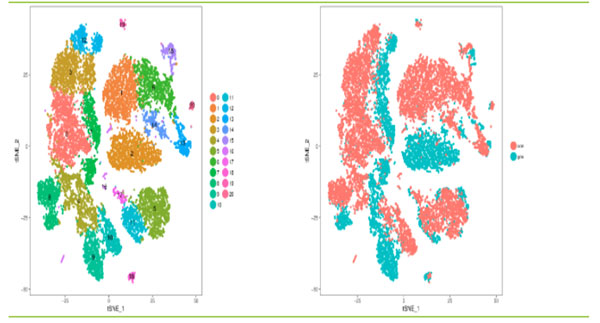
1.单细胞亚群分类
针对PCA结果中选取前10个主成分,采用graph-based聚类方法对细胞进行分类。使用相同的数据进行t-SNE分析,然后将聚类结果在t-SNE映射中展示。
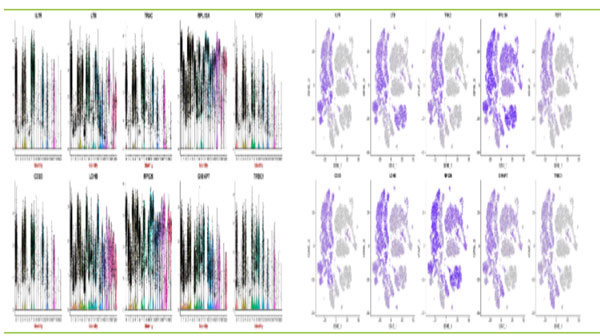
2.Marker基因分析
细胞群体Top10 Marker基因的小提琴图和表达映射图
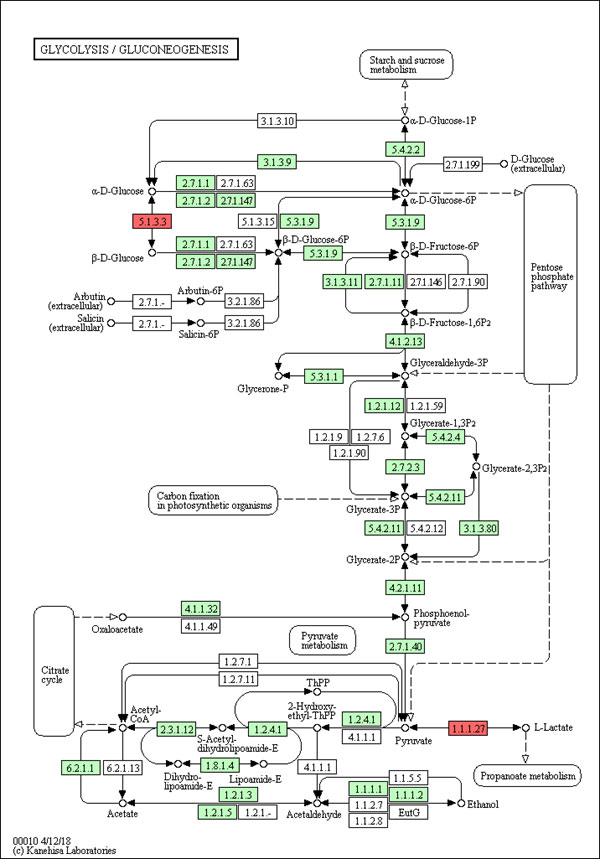
3.差异基因KEGG富集性分析
Pathway通路图展示与说明:红色代表注释到某个ko节点且上调的显著差异表达转录本,蓝色代表注释到某个ko节点且下调的显著差异表达转录本,橘黄色代表注释到某个ko节点不仅有上调又有下调的显著差异表达转录本。方框内的4位数字表示各种酶的EC编号;空心圆圈表示小分子化合物;实心箭头表示生化反应的方向;虚线箭头连接其他的相关代谢途径。下图仅为报告中的展示图片

 样本类型
样本类型 技术路线
技术路线 分析内容
分析内容 样本类型
样本类型 代表性文章
代表性文章 案例展示
案例展示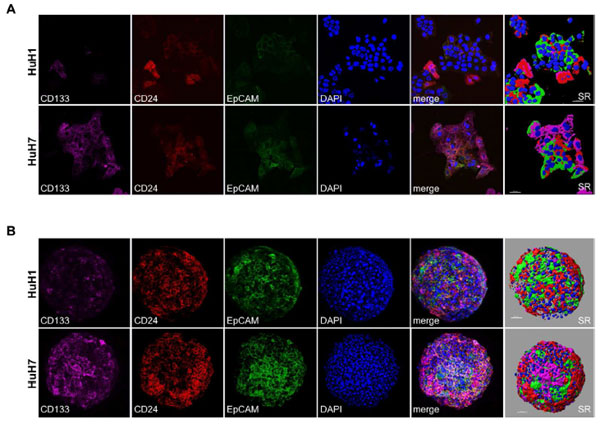

 参考文献
参考文献  结果展示
结果展示